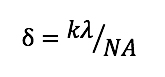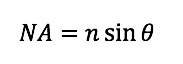執筆:柿木佐知朗 (関西大学)
光学顕微鏡(Optical microscope)や蛍光顕微鏡(Fluorescence microscope)は、材料や細胞の二次元形状を、主に“直接観察する”ために用いられます。材料や細胞に光を照射し、透過もしくは反射する光を二組の凸レンズで拡大観察することによって、形状や分子の分布、それらの経時的な変化(タイムラプス)などの情報を得ることができます。
測定できること
材料表面 / 二次元形状 / 細胞・細胞内小器官 / 分子分布 / 経時変化
原理
光学顕微鏡と蛍光顕微鏡
小学校で観察池の微生物たちを顕微鏡で見た時の感動を強く記憶されている方は多いと思います。私たちの肉眼で見える大きさは100 um程度なので、ゾウリムシは目を凝らせば小さな粒として見えますが、細胞や細菌になると全く見えません。光学顕微鏡は、肉眼では見ることのできない微小な物体を拡大して観察するための装置であり、生物や医学を中心とした広い分野の発展に貢献しています。光学顕微鏡は光を利用して像を得る顕微鏡の総称で、光を試料に照射した際に生じる蛍光を観察する蛍光顕微鏡は光学顕微鏡の一種となります。
1.原理と基本構成1)-3)
光学顕微鏡は、紫外線から可視光線、赤外線あたりの波長の光を対象とし、ガラスレンズによってそれらを直進・反射・屈折させて幾何学的に像を操作することを基本としています。通常、光学顕微鏡は光源と二つの凸レンズ(対物レンズ・接眼レンズ)によって構成されています。
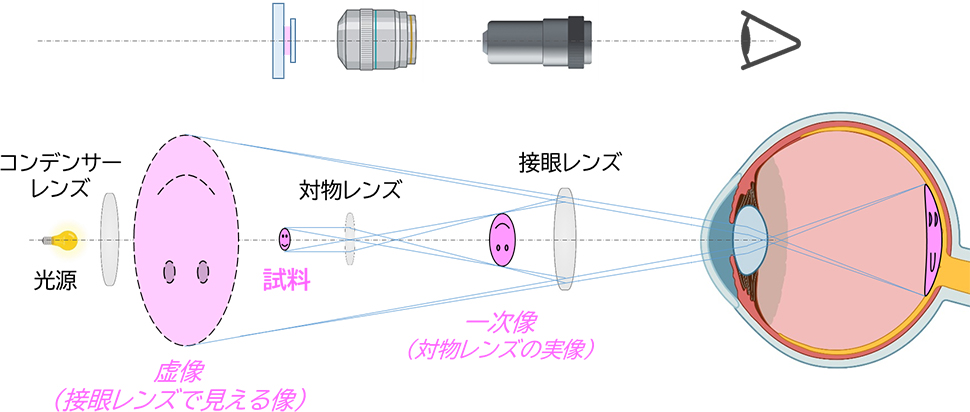 図1 光学顕微鏡の基本的な光学系
図1 光学顕微鏡の基本的な光学系
図1に示すように対物レンズの遠位に試料を置くと、光源から出た光はコンデンサーレンズによって集光され、試料を透過して対物レンズに入ります。この試料像は、対物レンズによって一次像(倒立した実像)に拡大され、さらに一次像を接眼レンズによって拡大することで虚像を観察することができます。ほとんどの顕微鏡には数種類の倍率の対物レンズがレボルバーに取り付けられており、対物レンズの取り付け面から試料および接眼レンズの取り付け面までの距離が一定に保たれているため、対物レンズを転換してもフォーカスはずれません。
光学顕微鏡は、対物レンズ(結像系)と接眼レンズ(観察系)に加えて光源やコンデンサーレンズなどの照明系とスタンドやレボルバーなどの機械系によって構成されています。図2には代表的な正立型顕微鏡の各部の名称を示しています。ベース(鏡台)とアーム(鏡柱)を本体とし、試料(標本)を保持するステージが備えられています。粗動および微動ハンドルでステージを上下に動かすことで、試料と対物レンズ先端の間の距離を調整してフォーカスを合わせます。
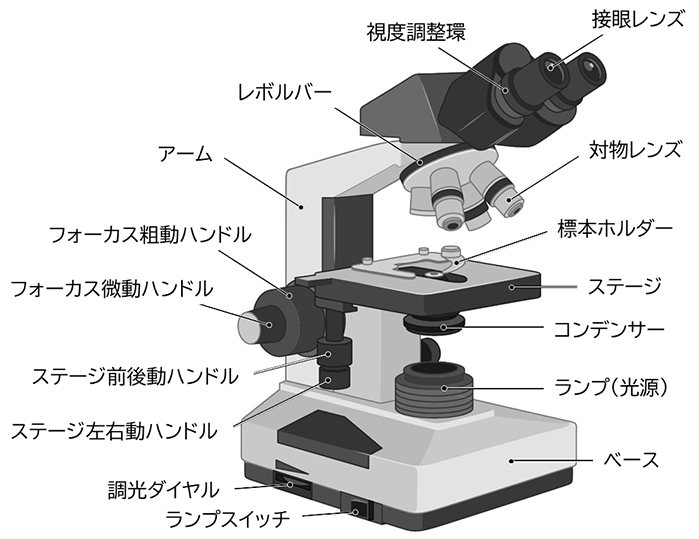
図2 正立型顕微鏡の各部名称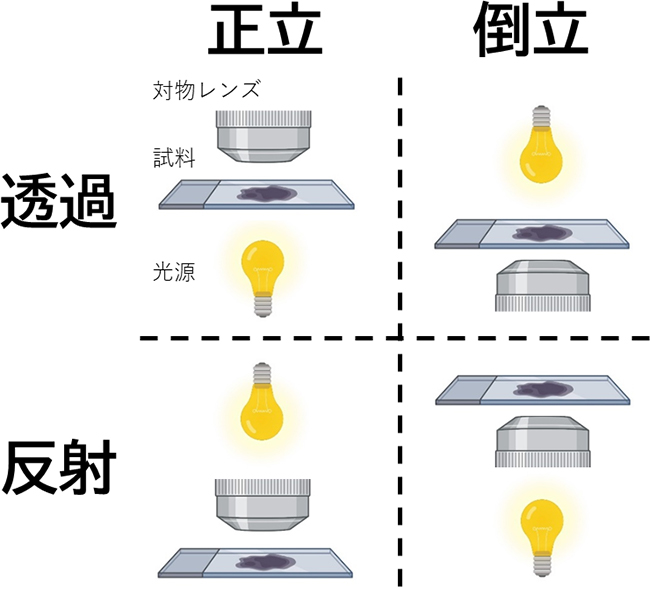
図3 基本的な光学顕微鏡の分類
さらに、光学顕微鏡は、図3示すように、試料の観察方向と照明方法によって4種類に大別されます。試料を上方から観察する(対物レンズが試料の上にある)タイプを正立型、試料を下方から観察する(対物レンズが試料の下にある)タイプを倒立型と分類します。また、試料を透過した照明光を観察するタイプを透過型、試料に照明光を当てて反射してきた光を観察するタイプを反射型(落射型)と分類します。観察する試料に応じて使い分けられ、例えば、シャーレに接着した培養細胞のように光を透過し、上方からでは対物レンズを近付けることができない試料は倒立型顕微鏡による透過照明によって観察され、高分子や金属のプレートのように光を透過しないが、上方から対物レンズを近付けることができる試料は正立型顕微鏡による反射(落射)照明によって観察されます。
2.顕微鏡の光学系
光学顕微鏡には、「どれだけ拡大できるか(倍率)」だけではなく、「細部を識別できるか(分解能と開口数)」も求められます。分解能とは、微小に接近した2点を識別できうる最小の距離(
δ)のことで、以下の式で表されます。
係数
kには一般に0.5が使われ、波長λは可視光では0.55 μmとなります。
NAは対物レンズの開口数で、下の式で表されます。
図4に示すように、この式の
nは対物レンズ先端と試料の間の媒質の屈折率、
θは光軸と対物レンズの一番外側の光線がなす角度(開口角)となります。これら二つの式から、開口角
θが大きくなると
NAは大きくなり、
δが小さくなる、つまり分解能は高くなります。
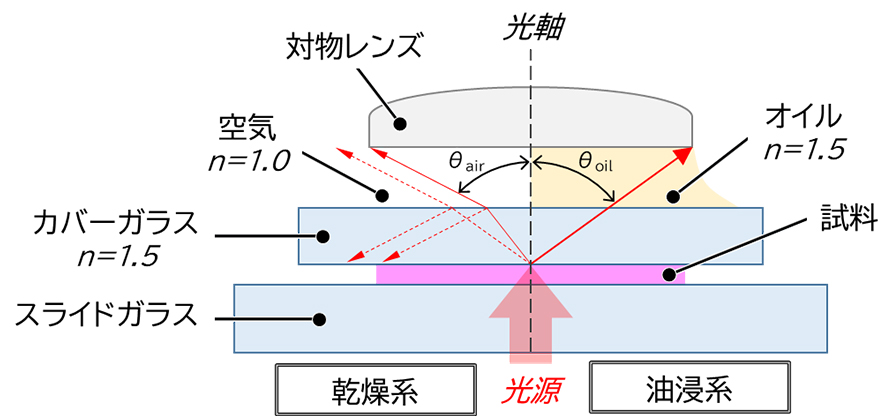 図4 対物レンズの開口角と屈折率
図4 対物レンズの開口角と屈折率
一般的な乾燥系対物レンズの場合、光源から出た光はスライドガラス→試料→カバーガラス→空気を透過して対物レンズに入ります。屈折率がカバーガラス(n=1.5)と媒質である空気(n=1.0)では大きく異なるため、試料(観察面)からの光はカバーガラスと空気の界面で反射もしくは屈折し、対物レンズに入る光量が少なくなります。この時、空気の屈折率は1なので、開口数が1を超えることはありません。一方、媒質としてカバーガラスに近い屈折率をもつオイルを充填する油浸系対物レンズの場合、反射や屈折を最小限に抑えつつ試料(観察面)からの光を対物レンズへ誘導することができます。オイルの屈折率は1.5なので、乾燥系と比較すると開口数が大幅に向上し、分解能も高くなります。
上述したように光学顕微鏡の性能は「倍率」と「分解能」に大きく依存していることから、対物レンズは光学顕微鏡の心臓部とも言うべき重要な部品です。対物レンズは、収差補正と観察方法によって分類されており、観察する試料・方法によって使い分けられます。収差とはレンズによって作られる結像の理想像とのずれのことで、表1に示すように色収差および像面湾曲収差を補正するのが一般的です。光が対物レンズに入射される際に分散して生じる収差が色収差、対物レンズの湾曲によって生じる収差が像面湾曲収差となります。
表1 収差補正の分類とその内容
さらに、対物レンズは観察方法によっても分類されています。例えば、油浸観察する際は油浸用レンズ、蛍光観察する際は紫外線吸収の少ない蛍光用レンズを選択する必要があります。図5に示すように、対物レンズには仕様が表示されています。倍率や開口数に加えて、機械的鏡筒長(対物レンズの取り付け面から接眼レンズ取り付け面までの距離 (mm))、カバーガラスの厚さ(mm)、視野数(接眼レンズで見える中間像の直径 (mm))や作動距離(対物レンズの先端から試料面までの距離 (mm))など、観察に必要な情報が表示されています。光学顕微鏡を実験で使う際、観察方法や目的に適した対物レンズが装着されており、対物レンズの表示に準じて顕微鏡の各部を設定できているかを確認することは、綺麗な観察像を得るための鉄則です。
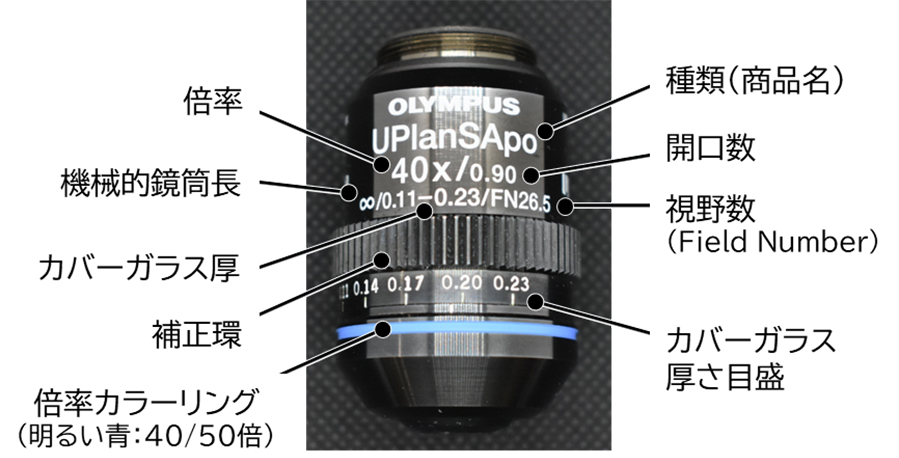 図5 対物レンズと性能表示
図5 対物レンズと性能表示3.代表的な観察法
光学顕微鏡には光の特性を利用したいくつかの観察法があり、それらは試料や目的に応じて使い分けられています。代表的なものに、明視野観察法、暗視野観察法、位相差観察法、微分干渉観察法、偏光観察法(別項参照)、蛍光観察法があります。明視野観察法は光源の光で照明された試料を対物レンズと接眼レンズを用いて拡大観察する一般的な方法で、暗視野観察法はコンデンサを利用して照射光が対物レンズに入らないようにすることによって試料で反射・散乱・屈折した光を観察する方法です。
3.1 位相差観察法
位相差観察法は、培養細胞のように光をほとんど吸収しない無色透明の物体(位相物体)を見るための観察方法です。位相物体は、照射光と物体を透過した光の間での位相の差が小さいので肉眼では識別できません。これは、照射光(直接光)と物体を透過した光(回折光)の位相の差を大きくすれば明暗のコントラストを増強され、物体を識別できるようになることを意味しています。そこで、図6に示すように、リング絞りをコンデンサーレンズの前側焦点に、位相板を対物レンズの後側焦点にそれぞれ配置して共役させることで直接光の位相を1/4λ(λは波長)進める、つまり直接光と回折光の位相差を1/2λに大きくすることで結像のコントラストを増強させることができます。図7のように、培養細胞のような位相物体は明視野観察法ではほとんど見えませんが、位相差観察法では細胞小器官によって透過光に位相差が生じるのでコントラストとして見ることができます。位相差顕微鏡では、厚みのある試料の場合、像の境界部分に光のにじみが生じるという欠点があります(ハロ現象)。
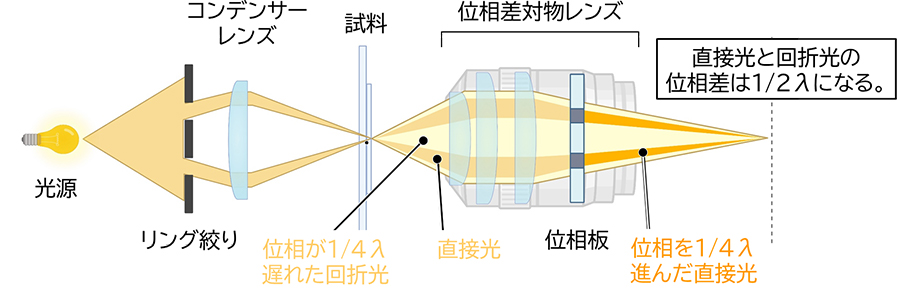 図6 位相差顕微鏡の原理
図6 位相差顕微鏡の原理
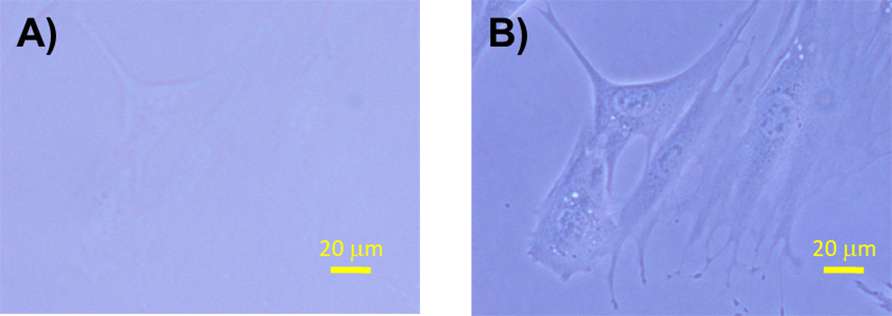
図7 細胞培養用ポリスチレン製シャーレに接着する線維芽細胞の明視野観察像(A)と位相差観察像(B)
3.2 微分干渉観察法
微分干渉観察法は、偏光干渉を利用して位相物体を可視化する方法です。ごくわずかに離れた二つの直線偏光(振動方向は直交している。偏光間の距離をシア量と呼ぶ。)が位相物体を透過すると個々に位相がずれるので、それらを合成すると位相のずれに対応した干渉色のコントラストを得ることができます。図8(A)に示したように、二つの直線偏光は透過した物体の厚さに応じて位相がずれるため、位相の差が大きい場合、二つの直線偏光間(ΔS:シア量)において透過距離(ΔT)が大きいことを意味します。この位相の差を像とすると、位相物体を立体的に見ることができます。図8(B)のように、光源の光をポラライザで直線偏光とし、ウォラストンプリズムで振動方向が直交する二つの直線偏光に分離します。これらを位相物体(試料)に透過させ、ウォラストンプリズムおよびアナライザで合成することで像とします。シア量を対物レンズの分解能以下にすることで像は二重にならず、位相のずれに相関して生じる干渉色のコントラストとして観察することができます。
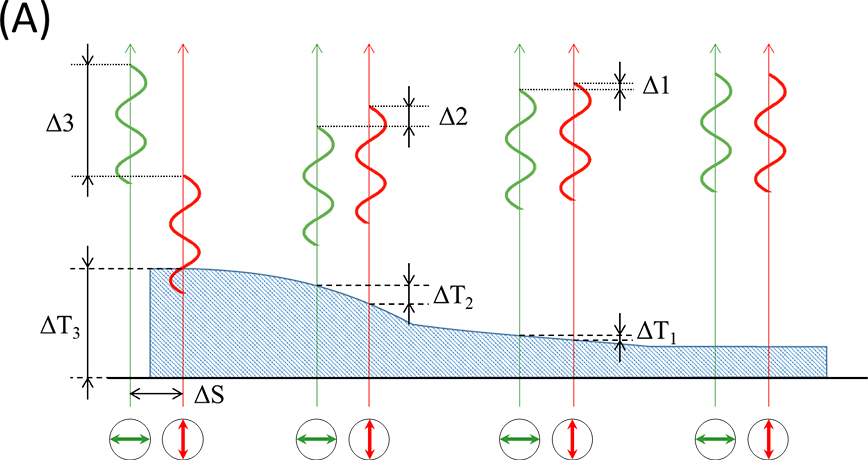
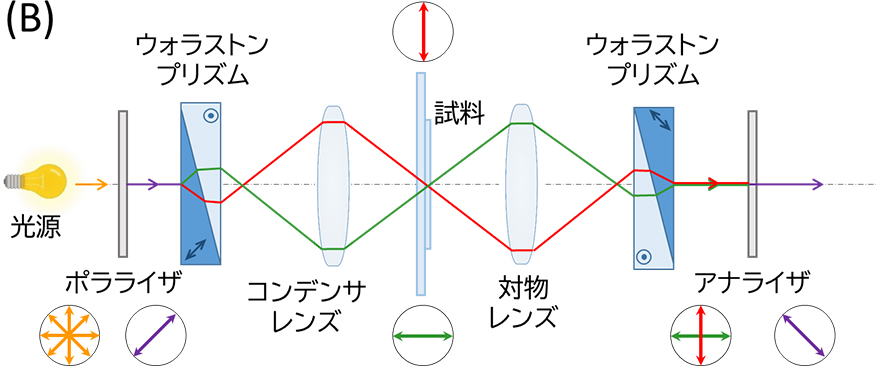 図8 微分干渉観察法の原理
図8 微分干渉観察法の原理
(A)直線偏光が厚みのある位相物体を通過する際の位相のずれ
(B)微分干渉顕微鏡の構成
蛍光観察法は、物質に光(励起光)を照射することで生じる光(蛍光)を観察する方法です。蛍光顕微鏡は、開発当初(1900年初頭)、微生物や植物組織が発する自家蛍光(一次蛍光)を観察の対象としていましたが、現在は主に蛍光色素を利用した特定の分子の観察に活用されています。
基底状態にある蛍光色素に紫外線や可視光線を照射すると、そのエネルギーを吸収して励起状態に遷移します。励起状態の蛍光色素は、エネルギーを光として放出しながら緩和過程を経て基底状態に戻ります。この一連の過程において、励起するために照射した光が励起光、基底状態に戻る際に放出される光が蛍光です。図9に示すように、蛍光色素の蛍光スペクトルは励起光の吸収スペクトルよりも長波長側にシフト(ストークスシフト)するので、この差を利用すれば蛍光色素が発する蛍光のみを観察することができます。蛍光を観察するためには、特定波長の励起光や蛍光を分離するフィルターに加えて、蛍光強度が励起光の強度の1/100000程度と微弱であることから、高強度の光源、より量子収率の大きい蛍光色素、高感度カメラなどが求められます。蛍光顕微鏡は、図10で示す構成を基本としています。光源からの光は波長と位相が揃っていないので、励起フィルターによって蛍光色素に適した波長の励起光とします。励起光はダイクロイックミラーで反射され、対物レンズを通過して試料(蛍光色素を含む)に照射されます。生じた蛍光は対物レンズとダイクロイックミラーを通過しますが、ここには反射した励起光も含まれるため、蛍光フィルターで蛍光だけを透過(反射した励起光を遮断)させて高感度カメラで検出することで結像します。
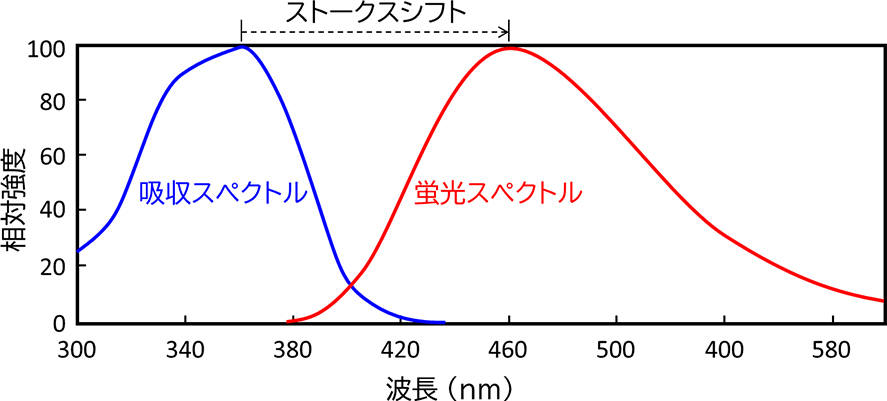 図9 蛍光色素の吸収スペクトルと蛍光スペクトル
図9 蛍光色素の吸収スペクトルと蛍光スペクトル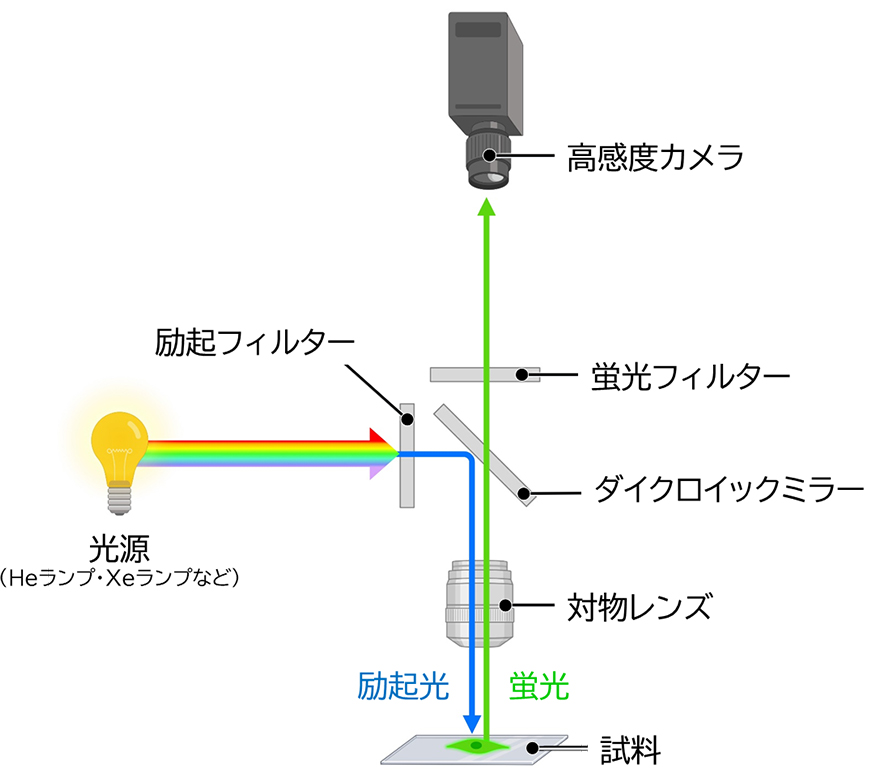 図10 蛍光顕微鏡の基本構成
図10 蛍光顕微鏡の基本構成
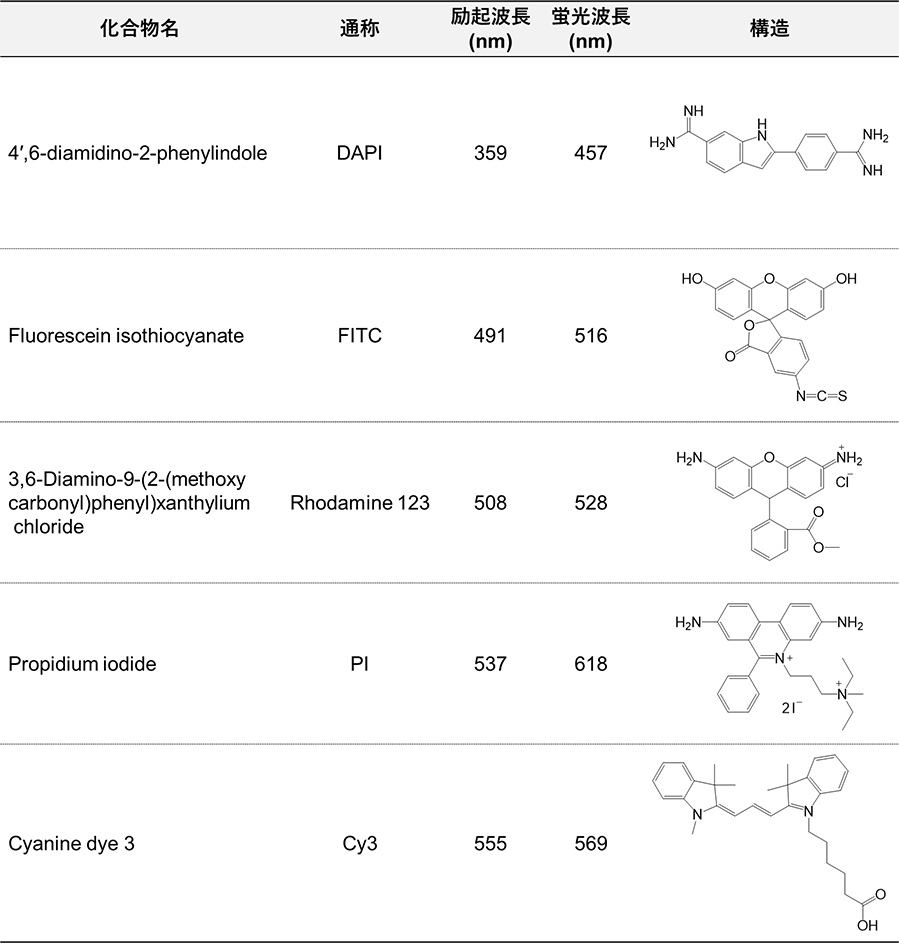
表2 蛍光色素の例
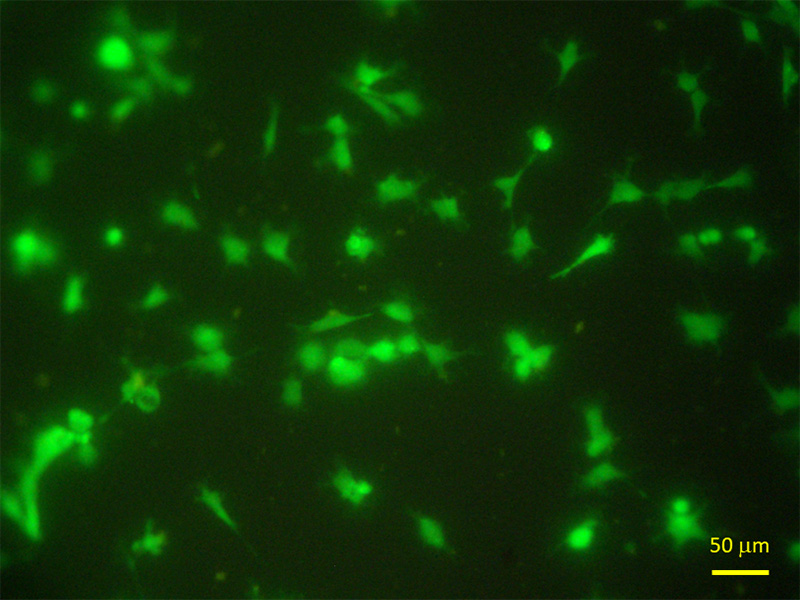
現在、とくに生物・医学の分野では沢山の種類の蛍光色素が蛍光顕微鏡観察で利用されています(表2)。例えば、細胞核の蛍光染色には二本鎖DNAと強く結合するDAPI(4’,6-diamidino-2-phenylindole)が、死細胞の蛍光染色には不安定化した細胞膜を透過するPI(Propidium Iodide)が用いられています。蛍光顕微鏡は、蛍光色素に励起光を照射して生じる蛍光を観察することから、光を透過しない基材上に存在する試料を観察することもできます。図11は、表面改質したテフロン基材上に接着している生細胞をCellTracker™ Green CMFDA Dye(Invitrogen™)で蛍光標識し、倒立型蛍光顕微鏡で観察したものです。最近では、レーザーを光源とし、特にz軸方向の分解能に優れている共焦点レーザー顕微鏡が広く利用されていますが、蛍光顕微鏡でも基材に接着した細胞の形態などは綺麗に観察することができます。
図11 表面を改質したテフロン基材上に接着したヒト臍帯静脈内皮細胞4, 5)
参考文献
1) 山科正平,高田邦昭,ライフサイエンス顕微鏡学ハンドブック,朝倉書店,2018
2) 野島博,無敵のバイオテクニカルシリーズ顕微鏡の使い方ノート,羊土社,1997
3) 長野主税,光学顕微鏡の技術系系統化調査,国立科学博物館技術の系統化調査報告 Vol. 27, 2017
4) S. Kakinoki et al., J. Biomed. Mat. Res. A, 106, 491-499(2018)
5) S. Kakinoki et al., Bioconj. Chem., 26, 639-644(2015)