執筆:松崎典弥(大阪大学)
共焦点レーザー顕微鏡法(Confocal Laser Scanning Microscopy: CLSM)は、高分子材料の内部構造や高分子の局在を解析する手法
共焦点レーザー顕微鏡(Confocal Laser Scanning Microscopy: CLSM)は、高分子材料の内部構造を三次元的に観察することができます。例えば、高分子ゲルを観察すると、ポリマー濃度の高い領域の反射像を得ることができます。また、蛍光分子を高分子に化学修飾することで、蛍光標識高分子の材料内部の分布や細胞内部での局在を観察することができます。
測定できること
ゲルの網目構造解析 / マクロドメイン構造解析 / 高分子の局在解析 / 一分子解析 / 細胞の構造解析
原理
共焦点レーザー顕微鏡の原理
共焦点レーザー顕微鏡(Confocal Laser Scanning Microscopy: CLSM)は、点光源(ピンホール1)から照射された照明光がサンプル表面に焦点を結ぶ時、その反射光もピンホール2を経て検出器上に焦点を結ぶように設計されているため、共焦点(コンフォーカル)光学系と呼ばれます(図1)。通常の顕微鏡の光学系は点光源(ピンホール1)でないため光の位相がそろっておらず、検出器前のピンホール2もないため、焦点位置以外の光をカットすることができず、干渉の影響を受けます。1957年にミンスキーが発明し
1)、ウィルソンらによって結像特性の研究が進み
2)、1985年に販売されました。
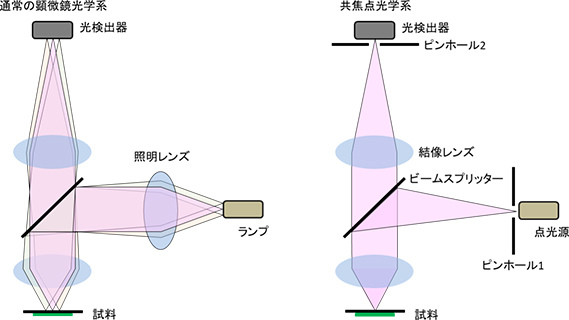 図1 通常の顕微鏡光学系と共焦点光学系の違い
図1 通常の顕微鏡光学系と共焦点光学系の違い高分子材料の内部構造観察
CLSMでは、焦点位置以外の光はピンホールでカットされるため、深さ方向(z方向)に分解能が生じ、光学的断層像を得ることができます。これは通常の顕微鏡では実現できないことです。三次元的な観察ができる特徴を活かして、高分子材料の内部構造、例えば、高分子ゲルの網目構造の観察などに古くから用いられてきました。高分子ゲルの内部構造の不均質性に関する研究として、多くの場合、光散乱法や原子間力顕微鏡による表面観察が行われてきました。しかし、これらの手法では、実空間の高分子ゲル内部構造を三次元的に解析することは困難でした。廣川は、CLSMによる高分子ゲルの内部構造観察を報告しました
3)。
N-イソプロピルアクリルアミド(NIPPAm)を架橋剤として
N,
N’-メチレンビスアクリルアミド、開始剤として過硫酸アンモニウムを用いて温度を変えてゲル化すると、20℃で調製したゲルは無色透明ですが、poly(NIPPAm)の相転移温度である32℃付近あるいはそれ以上の温度で調製したゲルは白濁状態になります。この白濁は、ポリマー密度の高い領域と低い領域の形成による不均質状態が原因ですが、それを直接観察することは困難でした。廣川は、これらのゲルをCLSMで観察し、反射像が示す明るい部分は高分子網目鎖の高密度な疎水性ドメイン、暗い部分は低密度な親水性ドメインであり、三次元的に共連続なドメイン構造であることを報告しました(図2)。
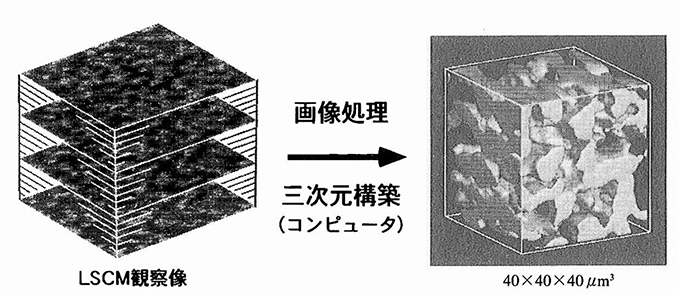 図2 共焦点レーザー顕微鏡により観察されたスライス像を基に構築された三次元像3)。
図2 共焦点レーザー顕微鏡により観察されたスライス像を基に構築された三次元像3)。
高分子材料の相分離構造の観察にもCLSMが用いられてきました。ポリマーブレンドやブロックコポリマーなど、ポリマーアロイと称される多成分多相系高分子材料は、樹脂や薄膜、ゴムなど、エンジニアリングプラスチックの開発に重要です。ポリマーアロイの物性は、その相分離構造と密接に関係するため、内部構造の詳細な三次元解析が必要であり、CLSMが古くから用いられてきました。1993年、Boerらは、スチレン-エチレンブチレン-スチレン(SEBS)ブロック共重合体とポリエーテルエステルの相分離構造の観察にCLSMを初めて用い、走査型電子顕微鏡と同様の相分離構造を三次元的に観察できることを明らかにしました
4)。また、橋本らは、スチレンブタジエンゴム(SBR)とポリブタジエン(PB)ブレンドの相分離構造をCLSMで三次元的に解析し、三次元フーリエ変換から得られた構造定数
S(q)がコンピューターシュミレーションと一致することを示しました
5)。このように、CLSMは、乾燥状態でなければ観察できない電子顕微鏡と異なり、高分子材料の実際の状態における内部構造の情報を与える解析手法として、高分子材料の発展に貢献してきました。
高分子材料の細胞内/外の局在観察
CLSMが最も威力を発揮してきたのは、細胞や生体分子の構造解析などの生命科学分野においてです。生命現象を明らかにするためには、細胞という生命の単位の中で遺伝子やタンパク質などの分子の動きを可視化することが重要であり、CLSMによって様々な重要な発見がもたらされてきました。また、CLSMは、高分子材料と細胞の相互作用の解析や、高分子材料の細胞内分布の解析にも貢献してきました。特に活躍したのは、ドラッグデリバリーシステム(DDS)の分野においてです。明石らは、ポリ(γ-グルタミン酸)に疎水性アミノ酸をグラフトした生体吸収性高分子が水中で疎水的に会合する際、オボアルブミン(OVA)などの抗原タンパク質を内包できることを見出し、ナノ粒子ワクチンに応用してきました。このナノ粒子の樹状細胞内での局在を明らかにするため、蛍光ラベル化ナノ粒子を用いてCLSMにより樹状細胞内部の分布を観察しました
6)。CLSMは深さ方向に分解能を有するため、細胞の内部に存在するのか、表面に吸着しているのか、区別することが可能です。これにより、ナノ粒子がOVAを効率よく樹状細胞内部にデリバリーできることが明らかにされました(図3)。
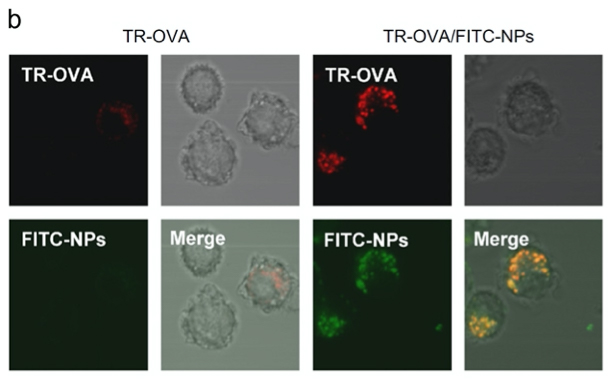 図3 共焦点レーザー顕微鏡によるテトラメチルローダミン(TR)標識OVA(TR-OVA)とフルオレセイン標識ナノ粒子(FITC-NPs)の樹状細胞内部の局在観察6)
図3 共焦点レーザー顕微鏡によるテトラメチルローダミン(TR)標識OVA(TR-OVA)とフルオレセイン標識ナノ粒子(FITC-NPs)の樹状細胞内部の局在観察6)
また、我々も最近、蛍光標識した高分子材料のがん細胞膜上の局在を報告しました。腫瘍周囲の微小環境は、pHがおよそ6.5の弱酸性であることが知られています。この腫瘍の特徴を活かし、血中を循環している時は1~数分子レベルで存在し(50 nm以下)、腫瘍周囲の弱酸性に応答して疎水性会合することでがん細胞膜を破壊する新しい機能性高分子(モレキュラーブロック:MB)を合成しました
7)。この分子の細胞表面での局在を解析するため、フルオレセイン標識MBをがん細胞とインキュベートすると、細胞膜に吸着してがん細胞を破壊する様子がCLSMで確認できました(図4)。CLSMにより、細胞内・外での高分子材料の局在を時空間的に理解することが可能となりました。
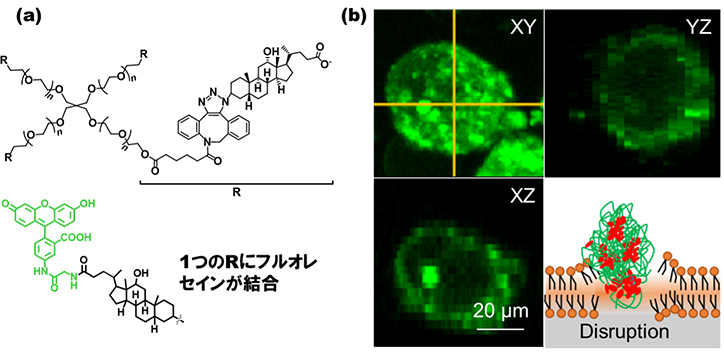 図4 (a)1つの末端がフルオレセイン標識されたMBの構造式. (b)共焦点レーザー顕微鏡による蛍光標識MBのがん細胞表面での局在の観察7).
図4 (a)1つの末端がフルオレセイン標識されたMBの構造式. (b)共焦点レーザー顕微鏡による蛍光標識MBのがん細胞表面での局在の観察7).おわりに
以上のように、CLSMは、高分子材料の内部構造観察からDDS分野におけるナノ粒子の細胞内局在観察まで、高分子化学分野に多大なる貢献を残してきました。近年、CLSMを応用することで生体分子を1分子でイメージングできる「1分子蛍光イメージング」
8)も可能となっており、今後、CLSMのますますの展開が期待されています。
参考文献
1) M. Minski, U.S. Patent 3013467 (1957).
2) T. Wilson et al., Theory and Practice of Scanning Optical Microscopy, Academic Press (1984).
3) 廣川能嗣,高分子,48 (6),400-403 (1999).
4) H. Verhoogt et al., Polymer 34, 1325-1329 (1993).
5) H. Jinnai et al., Macromolecules 28, 4782-4784 (1995).
6) T. Akagi et al., Biomaterials 28, 3427-3236 (2007).
7) H. Nakatsuji et al., Mater. Horiz. (2021) in press. DOI: 10.1039/D0MH02058C.
8) 船津高志,化学と生物,44 (1), 34-38 (2006).



