執筆:織田昌幸(京都府立大学)
等温滴定型熱量計(Isothermal Titration Calorimetry: ITC)は結合熱や反応熱を計測する装置
等温滴定型熱量計(Isothermal Titration Calorimeter: ITC)は、一定温度下で滴定に伴う熱量変化を検出する装置で、主に分子間相互作用解析に用いられます。分子同士が結合する時に発生する微小な熱量変化を計測し、得られる滴定曲線から、結合比(
n)、結合定数(
Ka)、結合のエンタルピー変化(Δ
H)を決定でき、さらに結合のGibbs自由エネルギー変化(Δ
G)やエントロピー変化(Δ
S)を一意的に算出できます。
測定できること
結合熱 / 反応熱 / 結合親和性 / 結合エンタルピー変化量 / 結合エントロピー変化量 / 結合比
原理
高感度な等温滴定型熱量計(Isothermal Titration Calorimetry: ITC)として、2つのメーカー(A社とB社)の装置が知られています。著者は主にA社装置のユーザーで、本稿ではその使用経験に基づき、執筆させていただきますが、装置の概要や実験方法などは共通部分が多いです。
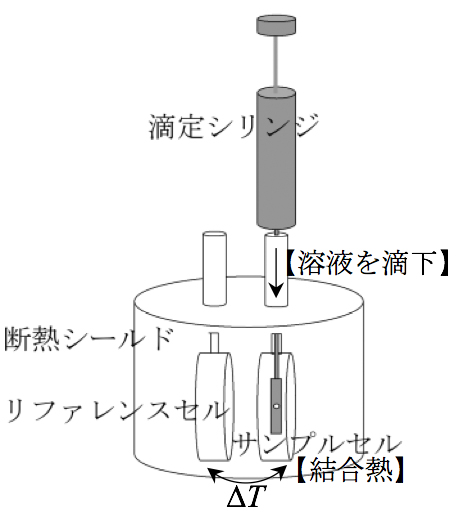 図1 ITC装置の概略
図1 ITC装置の概略
図1にITC装置の概略を示します。ITC測定にあたり、装置の滴定シリンジとサンプルセルそれぞれに、相互作用を解析する2種類の試料を充填します。測定に必要な試料量は、A社の最新機種PEAQ-ITCで、滴定シリンジ体積(最大):40 μL、サンプルセル体積:200 μL、B社の最新機種Affinity ITCで、滴定シリンジ体積(最大):250 μL、サンプルセル体積:190 μL(または1 mL)です。試料濃度は、相互作用に伴うΔ
Hに大きく依存するので、適当な濃度で一度測定を行い、得られるデータから最終的に判断することになります。一般的には、結合が弱い相互作用ほど、高濃度の試料を必要とします。また滴定終了時点でシリンジ側試料の物質量がセル側試料の2倍程度となるように設定し、
Kaが10
6 M
-1より小さくなる系(結合が弱くなる系)では、その割合を高くする必要があります。なおΔ
Hなどの熱力学量決定にあたり、試料の濃度が直接影響します。そこで試料の濃度決定にあたっては、吸光度計を用いるなどして、正確さを期す必要があります。また相互作用する2種類の試料のうち、一方の試料濃度のみ正確に決定でき、結合比も別法等により予測がつく場合などは、ITC測定により得られる結合比から補正する(例えば1:1に固定する)ことで、もう一方の試料濃度を決定することもできます。また滴定シリンジとサンプルセルに入れる試料の溶媒は、できるだけ同一にする必要があります。ミスマッチがあると、目的とする反応熱なのか、溶媒の混合熱なのかの判別が難しくなります。そこで準備する2種類の試料について、透析法などにより、適当な同一溶媒に置換します。ただし試料の安定性などが懸念される場合、測定直前に溶媒を付加することで、両試料溶液の組成をできるだけ同一にすることもあります。またバッファーの選択にあたっては、試料とバッファー間でのプロトン交換に伴う熱量が観測されうるので注意を要します
1)。また生体分子間相互作用の熱力学量として、熱容量変化量(Δ
Cp)も重要な情報を与えます(Δ
Cp = ∂Δ
H/∂
T)。このΔ
Cpを得るためには、異なる温度でITC測定を行い、各温度で得られたΔ
Hの温度依存性から、Δ
Cpを算出することになります
2)。
実際の測定では、ITC装置の起動後、測定温度に設定、その他、各メーカー専用ソフトの指示に従い、各種パラメータを入力、設定します。セル側試料をサンプルセルに、シリンジ側試料を滴定シリンジに充填します。なおサンプルセルは断熱シールド内に固定されており、同セルへの注入口しか目視できないため、サンプルセルへの溶液の出し入れは、充填用シリンジでセルの底部がどこにあるかを探りながら行います。またサンプルセルの実体積よりも多めの試料量を準備し、試料充填時にサンプルセルの注入口から試料が溢れることを確認することが薦められます。測定パラメータの設定について、滴定回数は、解析時に十分なデータ点を得るため、通常は10回以上にします(1回の滴定のみで、データのデコンボリューションから相互作用パラメータを得る方法もある)。各回の滴下量は、得られる熱量の程度を鑑み、設定します。滴定回数とあわせて、最終的な滴定総物質量と、サンプルセル側試料の物質量との量比を、前述のように考慮する必要があります。また各回の滴下量は、異なる値を設定することもできます。滴定シリンジの試料注入口近くの試料量が不正確であり、1回目の滴下量を少なめに設定して、データ解析時には、この1点を一般的には除外します。滴定間隔は、対象とする相互作用の平衡状態にいたる時間を考慮して設定します。最新機種では、2分程度で十分で、20回の滴定の場合、測定開始から終了まで40分程度となります。
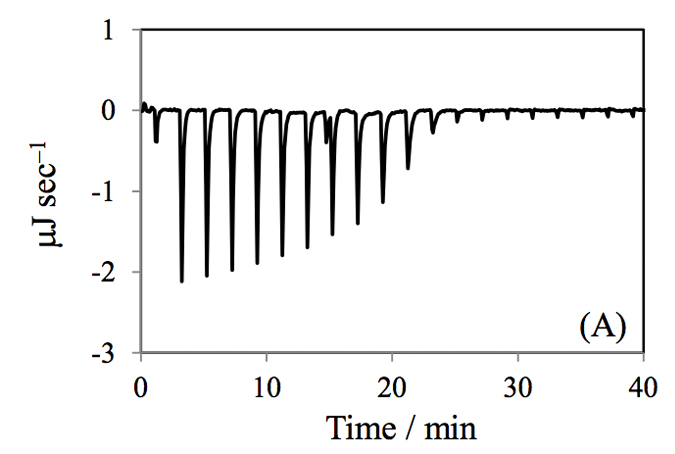
測定パラメータを設定し、試料を充填して、測定開始となります。測定開始後、自動的に測定温度での安定化、サンプルセルとリファレンスセルとの温度差の安定化、サンプルセルへのフィードバック電力の安定化が順次行われます。A社のITC装置は、サンプルセルとリファレンスセルとの温度差が常にゼロになるよう、サンプルセル表面の微小ヒータに一定の電力を供給する入力補償方式が採用されています。すなわち、サンプルセル内での分子間相互作用に伴い、発熱が生じるとフィードバック電力を減少させ、一方、吸熱反応の場合は増加させ、リファレンスセルとの温度差をゼロにしています。実際の測定生データは、このフィードバック電力の変化を検出しており、発熱反応では、見かけ上、負の向きへのピークとして、吸熱反応では正の向きへのピークとして観測されます(図2)。
(A)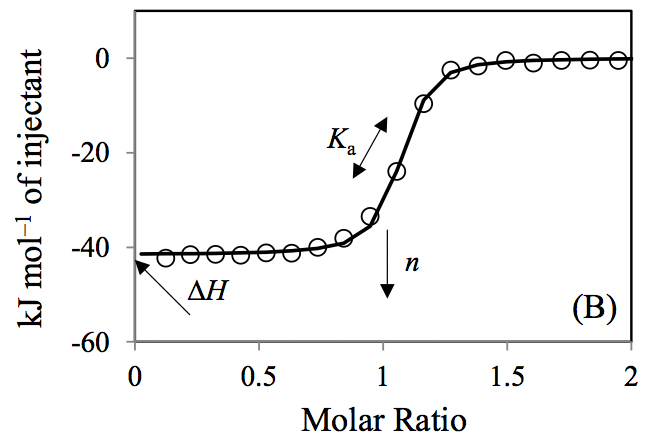
(B)
 (C)
(C)
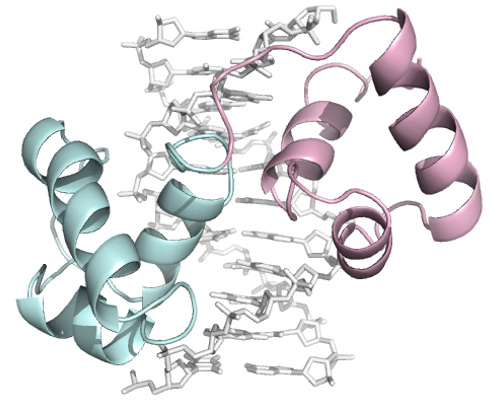
図2 ITCデータ(A)生データ(PEAQ-ITC),(B)解析データ滴定シリンジにDNA(300 μM), サンプルセルにc-Myb R2R3(30 μM)を入れ, 20℃で滴定実験を行った実験例3). 得られたパラメータは次の通り;n = 1.00, Ka = 1.53 × 107 M–1, ΔH = –41.8 kJ/mol. (C)c-Myb R2R3がDNAに結合した複合体構造(PDB; 1MSE)
一方、B社のITC装置も、断熱型入力補償方式は同様であるが、発熱反応および吸熱反応時のピークは、前述と逆向きに観測されます(発熱反応では、正の向きへのピーク)。測定開始後、終了まで、データの取り込みなど自動的に行われますが、もし途中で測定条件(各回の滴下量や滴定回数など)を変更したい場合は、アップデートも可能であり、適宜リアルタイムで表示されるデータを見ながら変更できます。
滴定シリンジで高濃度に存在する試料が、サンプルセル内で希釈されることに伴う熱量、希釈熱が、試料間の反応熱に加算される可能性があります。そこでこの希釈熱の寄与を補正するため、サンプルセル内に溶媒のみを充填させ、そこに滴定シリンジから、前述の滴定実験時と同一の試料を滴下する測定を行い、試料結合熱から希釈熱分を差し引きすることが薦められます。ただし稀にこの希釈熱以外の寄与が観測されることもあり、実際の測定の滴定終了前数回の滴定では、対象試料の結合熱が観測されない(理想的には希釈熱のみが観測される)程度まで過剰の試料を滴下することが薦められます。
ITC測定結果の解析は、データ解析ソフトOriginをベースにしたA社の解析ソフト上で行います。B社では、NanoAnalyzeというソフトが、同社HPからダウンロードでき、利用できます。いずれも最近のソフトはユーザーフレンドリーで、自動化が進んでいますが、ここでは敢えてマニュアルで行う使用法の概要を記載します。図2Aのような生データを読み込むと、各滴定ピークが自動的に積分され、さらに溶媒に試料を滴下した実験データをリファレンスデータとして、試料同士の滴定データから引き算して、図2Bのようなデータが得られます(積分範囲をマニュアルで指定することも可能)。ここで各試料濃度を入力し(測定時のパラメータとしても入力可能)、不要なデータ点(例えば前述のような1回目の滴定点)を削除します。次に1:1結合のようなモデル式を利用して、フィッティングを行います(図2Bの実線カーブ)。このフィッティングから、前述のように、
n、
Ka(または
Kd)、Δ
Hが決定されます。なおモデル式としては、各結合部位が等価な場合や、非等価な場合のモデルが用意されています。図2では、DNA結合タンパク質c-Myb R2R3とDNAとの結合実験例で
3)、1:1結合モデルでのフィッティングを行い、結果として結合比(
n)は、ほぼ1となります。このように結合比が直接的に決定できる点もITCの魅力であり、前述のように試料濃度の決定に逆利用できることや、試料の安定性の指標(例えば図2の実験系で、タンパク質試料の一部が変性していると、見かけ上の
nの値は1より小さくなる)として用いることもできます。
ITCを用いて酵素の活性測定を行うこともできます
4)。すなわち滴定シリンジとサンプルセルいずれかに、酵素または基質を充填し、滴定後の基質の変化に伴う熱力学量を経時的に観測します。この場合、滴定前での酵素と基質との混合の影響をできるだけ抑えるため、滴定シリンジに基質を、サンプルセルに酵素を入れるような実験系が推奨されます。一方、濃度調整の関係などで、滴定シリンジに酵素を入れる必要がある場合、滴定シリンジへの酵素の充填後、微量の溶媒を追加充填し、セルへの注入口付近からの漏出を抑える工夫もあります。
最新のITC装置は、付属の操作ソフト、解析ソフトともに、操作性に優れ、必要サンプル量も少なくなり、ある意味「ハードルの低い」装置になっています。さらにMicroCal PEAQ-ITC Automated(A社)やAffinity ITC Auto(B社)では、試料の充填から、サンプルセルや滴定シリンジの洗浄まで、完全自動化された装置も市販されています。なおITC測定のいくつかの実験例がまとめられた成書(ハンドブック)があるので、ITC測定初心者も経験者も参考にしてください
5)。
参考文献
1) Fukada, H. & Takahashi, K., Proteins, 33, 159-166 (1998)
2) Oda, M. et al., J. Mol. Biol. 276, 571-590 (1998)
3) Kawasaki, M. et al., Biophys. Chem. 258, 106319 (2020)
4) Karim, N. & Kidokoro, S., Netsu Sokutei, 33, 27-35 (2006)
5) 熱量測定・熱分析ハンドブック 第3版. 日本熱測定学会 (編集) (2020)



