執筆:嶋田直彦(東京工業大学)
ゲル電気泳動は(Gel Electrophoresis)生体分子のサイズによる分離・分析及び生体分子間相互作用を評価できる方法
ゲル電気泳動は(Gel Electrophoresis)は核酸やタンパク質等の生体分子を高分子ハイドロゲル中において電気泳動し、分子サイズに依存した泳動度の違いを利用して分離・分析する方法です。また、分子間相互作用を移動度の変化によって評価することもできます。
測定できること
核酸分離・分析 / タンパク質分離・分析 / 相互作用解析
原理
測定原理
電荷を有する分子は溶液中において、電場中に置かれると一定方向に向かって動き出します。この時、負電荷を有する分子は陽極側に、正電荷を有する分子は陰極側に泳動されます。高分子ハイドロゲル中において、これらの分子が泳動された時、網目からの抵抗を受けることで分子はそのサイズに依存してゲル中を泳動することが知られています。大きな分子ほど遅く、小さな分子ほど早く泳動されます(図1)。これは、高分子ゲルが作りあげる網目の間を分子が通り抜ける速度が、分子サイズに依存しているためです。分子量Mと相対移動度m
rの関係性はlog
M =
a -
bmr が成り立つことが一般的に知られています。
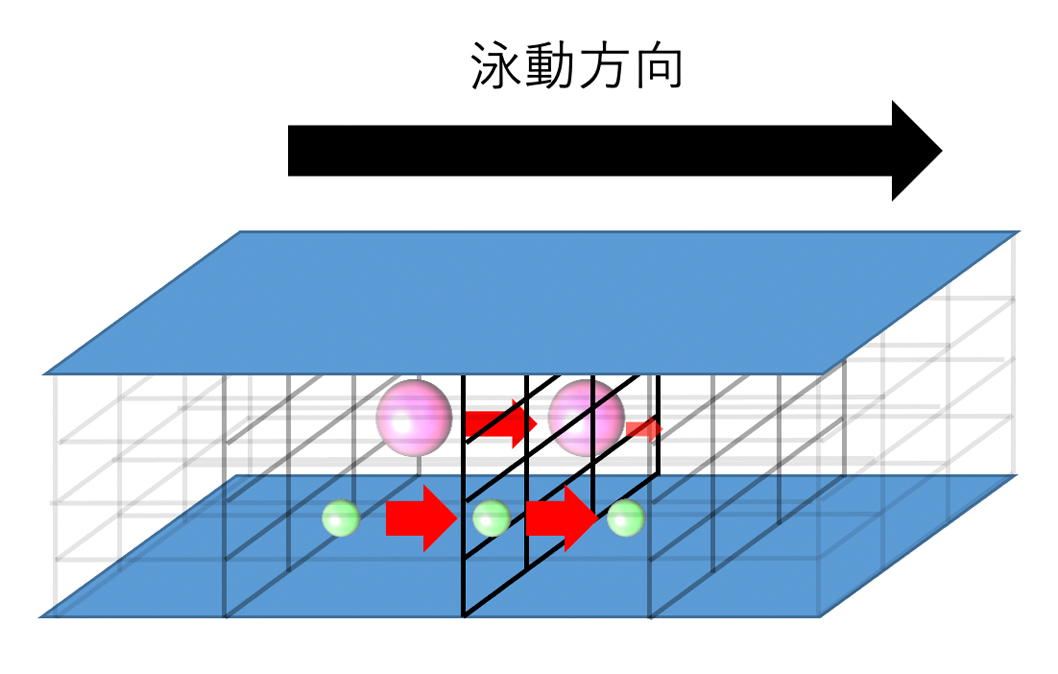 図1 ゲル内における物質の泳動のイメージ
図1 ゲル内における物質の泳動のイメージ
小さな分子(緑)は速やかにゲルの網目を通過するが, 大きな分子(ピンク)は網目に引っ掛かり通過するのに時間がかかる.
高分子ハイドロゲルとして、アガロースゲル並びにポリアクリルアミドゲルが主に使われます。一般的にアガロースゲルは大きな網目を持つため、プラスミドDNA等の100塩基対以上の大きな核酸分子の分析に使われます。ポリアクリルアミドゲルはタンパク質や数十塩基程度のオリゴ核酸の分析に用いられます。いずれも分離対象のサイズに応じてゲル材料の濃度を調整する必要があります。
アガロースゲル電気泳動
アガロースゲルは粉末のアガロースを加熱溶解させた後、型に流し込むことで作ります。この時、櫛状の形をしたコームを差し込むことで試料を注入(アプライ)する穴(ウエル)を作成します。グリセロールやスクロースで”重み”を付けたローディングバッファー(LB)に溶解させた試料を前述のウエルにアプライし、電気泳動を行います(図2)。この時、既知の塩基数をもつ核酸分子が数種類含まれる分子量マーカーもアプライしておきます。泳動後、核酸をエチジウムブロマイド等の蛍光性染色剤を使って可視化させます。主にPCR生成物の定性分析やクローニングの確認等によく用いられる手法です。
 図2 アガロースゲル電気泳動装置
図2 アガロースゲル電気泳動装置ポリアクリルアミド電気泳動
ポリアクリルアミド電気泳動(Polyacrylamide Gel Electrophoresis; PAGE)は大きく分けて3種類の方法(1.変性PAGE (Denaturing PAGE) 2.非変性PAGE (Non-denaturing PAGE) 3.SDS-PAGE)があります。それぞれ、分析する対象が異なっており、目的に応じて使い分ける必要があります。いずれのゲルにおいても、アクリルアミドを架橋剤であるメチレンビスアクリルアミドとともに過硫酸アンモニウムとN, N, N’, N’-テトラメチルエチレンジアミンを開始剤として、二枚のガラス板の間で重合することによって作製され、上から下へと泳動されます(図3)。
 図3 ポリアクリルアミド電気泳動装置
図3 ポリアクリルアミド電気泳動装置
- 変性PAGE (Denaturing PAGE)
変性剤と知られる尿素やホルムアミドが加えられたゲルを使用します。場合によっては加熱しながら泳動します。LBに変性剤を加え変性させた状態でウエルにアプライさせます。変性剤によって核酸塩基間の水素結合が抑制され、核酸は高次構造をとらない一本鎖の状態で泳動されます。よって、純粋にサイズに依存した泳動結果が得られるます。高次構造を取りやすい一本鎖DNAやRNAの鎖長の検定や酵素消化された際の鎖長変化の評価等に用いられます。また、DNAシーケンシングにも使われています。可視化には上述の蛍光性染色剤を使う他に、予め蛍光剤や放射性同位元素が付与された分子を用いることもできます。
- 非変性PAGE (Non-denaturing PAGE)
上記の変性剤を含まないPAGEです。Native PAGEとも呼ばれます。水素結合が保持された状態で核酸分子が泳動されます。すなわち二本鎖DNAや一本鎖核酸が高次構造を保った状態で泳動されます。核酸のハイブリダイゼーションや核酸結合性分子との相互作用によりバンドの移動度が変化(シフト)することから、核酸との分子間相互作用を評価することができます(図4)。この手法はゲルシフトアッセイあるいはエレクトロモービリティーシフトアッセイ(Gel shift assay/Electrophoretic mobility shift assay; EMSA)と呼ばれる。泳動による温度上昇を抑え、安定した結合を保持させるために、しばしば低温で泳動されます。可視化は上述の変性PAGEと同じ方法で行われます。
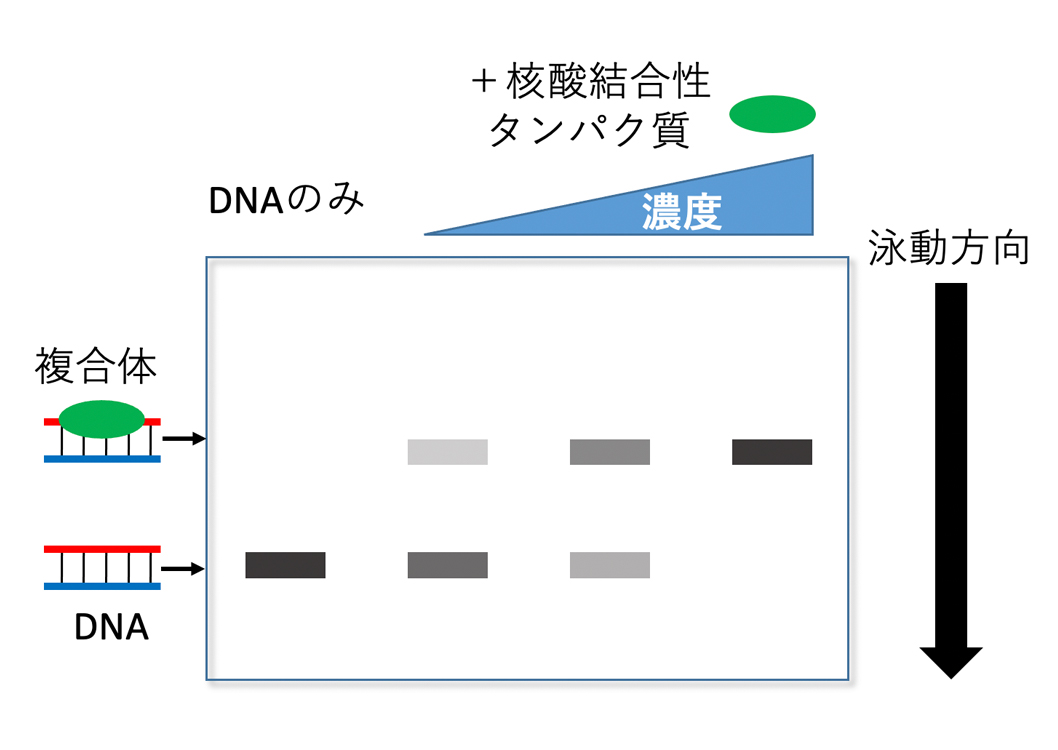 図4 ゲルシフトアッセイの概念図
図4 ゲルシフトアッセイの概念図
DNA結合性タンパク質を加えると, DNAのみのバンドに加え泳動距離が短い新たな複合体のバンドが現れる. 濃度上昇に伴って複合体のバンド強度は上昇し, 最終的にDNAのみのバンドは消失する.
- SDS-PAGE
ドデシル硫酸ナトリウム(SDS)が含まれたゲルです。主にタンパク質の分析に用いられます。ゲル及びLBに0.1%程度含まれるSDSと複合体を形成したタンパク質は棒状の形態をとると言われています。よって、様々な三次元構造を持ったタンパク質はSDSとの複合化により、すべて棒状に変化し、表面の電荷の違いや構造の違いには寄らず、分子量に依存した泳動がなされます。可視化にはクマシーブリリアントブルーが用いられることが多くCBB染色と呼ばれる(図5)。他に蛍光染色剤をもちいた染色や銀染色等の方法が用いられます。
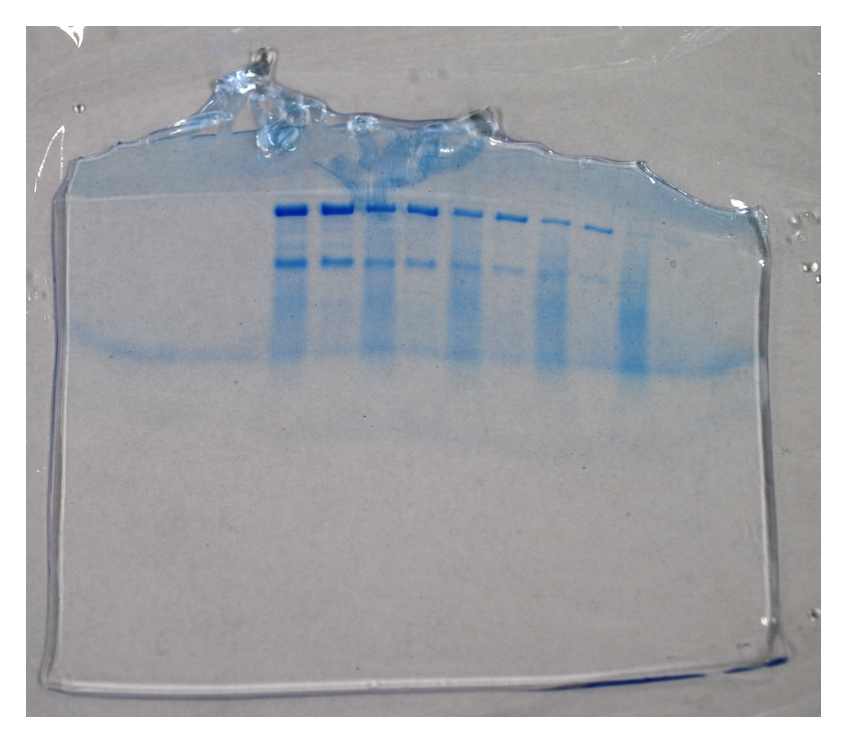 図5 SDS-PAGE後のCBBによる染色例
図5 SDS-PAGE後のCBBによる染色例




