執筆:蛭田勇樹(慶應義塾大学)
蛍光分光法は、スペクトルや蛍光強度を分析することで、定性・定量分析する手法
蛍光とは、物質に光を照射し、そのエネルギーにより得られる発光のことです。蛍光を発する分子の中には、分子がおかれている環境(温度や溶液の成分濃度)に応答して、蛍光強度や蛍光色を変化させる分子が存在します。こういった分子を利用した臨界ミセル濃度の測定法および細胞の温度分布イメージングについて紹介します。
測定できること
蛍光スペクトル / 励起スペクトル / 三次元蛍光スペクトル / 蛍光量子収率 / 臨界ミセル濃度 / 細胞の温度分布
原理
蛍光の基本原理
蛍光というと、コンサートなどで使うケミカルライトや蛍の光を思い浮かべることでしょう。正確には、それぞれ化学発光と生物発光になります。蛍光、化学発光、生物発光全て発光するわけです、どのように発光のエネルギーを得ているかによって異なってきます。基底状態(安定でエネルギー準位が低い)の分子が、何かのエネルギーによって励起状態(不安定でエネルギー準位が高い)となります。この際に、光を照射し、そのエネルギーを吸収して励起状態になるのが「蛍光」、化学反応によって励起状態になるのが「化学発光」、生物発光酵素ルシフェラーゼにより基質ルシフェリンの化学反応によって励起状態になるのが「生物発光」です。励起状態は不安定であり、すぐに基底状態に戻る時に過剰のエネルギーを光として放出し発光します。今回は、この中でも蛍光に注目して、これらが高分子分析にどのように利用されているのか、また、高分子と蛍光分子を結合させることで利用される分析法について説明していきます。
まず、どういった分子構造が蛍光性を示すか説明します。蛍光を示すには、光を吸収し、過剰のエネルギーを熱エネルギーや運動エネルギーではなく、光エネルギーとして放出する必要があります。分子は、基底状態と励起状態のエネルギー差と同じ大きさの光エネルギーを選択的に吸収します。人間の目が認識できる可視光のエネルギーを吸収するには、π共役系が拡張した分子構造を持つ必要があります。例えば、ベンゼン、ナフタレン、アントラセンと共役系が大きくなるほど吸収波長は長波長側にシフトしていきます。さらに、いくら光エネルギーを吸収できたとしても、励起エネルギーを光エネルギーとして放出(放射遷移)しなければ蛍光は観察されません。例えば、アゾ染料として知られるアゾベンゼンは強い発色(可視光の吸収)を示すが、蛍光を示しません。これは、励起エネルギーが分子運動や熱エネルギーとして放出(無放射遷移)されることで、基底状態に戻るからです。すなわち、分子運動(無放射遷移)を抑制することができれば、効率的に蛍光を示すようになります。ここで、アルカリ性で赤色を呈色するフェノールフタレインと緑色蛍光を示すフルオレセインの構造を比較します(図1)。フェノールフタレインの2つの芳香環をO原子で架橋するとフルオレセインになります。フェノールフタレインでは、芳香環が回転することができるために、無放射遷移で励起エネルギーを使ってしまうが、O原子によって回転を抑制された剛直な構造を持つフルオレセインは放射遷移すなわち蛍光として励起エネルギーを放出できます。
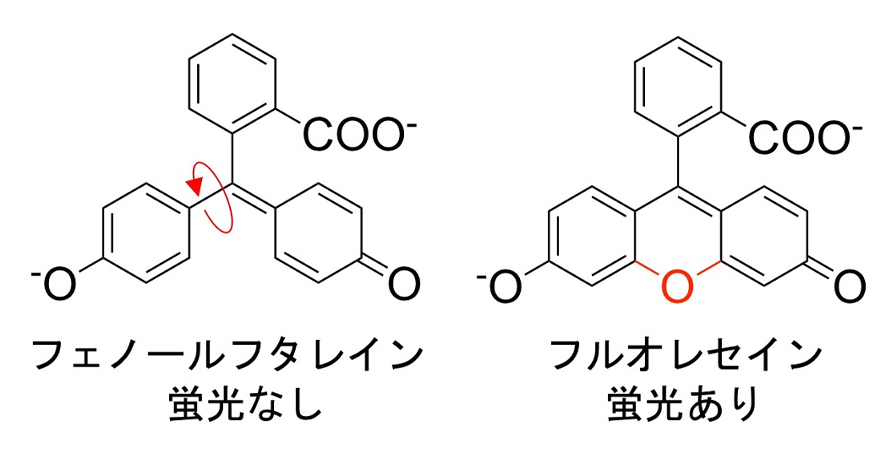 図1
図1
蛍光色素の蛍光特性は、分子の構造のみならず、分子が存在する環境に大きく影響されます。また、この環境応答性を利用することで、蛍光センサーへの応用が可能です。ここでは、ソルバトクロミック蛍光色素を利用した臨界ミセル濃度の測定方法、細胞内温度の蛍光測定法について説明していきます。ソルバトクロミック蛍光色素は、溶媒の極性によって、色(波長)、蛍光強度を変化させます。この現象を理解するために、蛍光の原理をJablonski図(図2)を用いて詳細に説明していきます
1)。まず、光の吸収(励起)は10
-15 sオーダーと分子が振動する時間と比べ非常に速く、基底状態(S
0)と励起状態(S
1)では、分子の動きは無視することができます(Frank-Condonの原理)。その後、振動緩和によってS
1の最低振動準位に達し、放射遷移により緩和され「蛍光」を発します。緩和の過程においてもFrank-Condonの原理が適用されます。ここでは、溶媒の極性が上がると蛍光波長が長波長シフトする分子内電荷移動型のソルバトクロミック蛍光色素についてその応答原理を説明します(図3)
1)。分子内に電子供与性基(D)と電子吸引性基(A)を持つ蛍光色素は、励起されると(D)部位から(A)部位へと電荷が移動し、分子内分極を起こします。この現象を分子内電荷移動(ICT)と呼び、励起状態において双極子モーメントが増大します。基底状態(S
0)では、励起状態(S
1)よりも双極子モーメントが小さいため、溶媒の配向性は小さいです(基底状態の分子に最も安定な溶媒和状態)。励起直後のS
1状態でもその溶媒の配向性は保存されています。励起状態S
1の寿命は十分に長く(10
-10-10
-7 s)、溶媒が双極子モーメントの増大した励起状態の分子の周囲で緩和され(励起状態の分子に最も安定な溶媒和状態)、より安定な状態となります。Frank-Condonの原理に従って、緩和されることで、基底状態へと戻るため、分子の双極子モーメントと溶媒の配向が合っておらず、不安定化されています。結果として、励起波長に比べて、蛍光波長のエネルギーが小さくなるため、長波長化します。より極性が高くなることで、この効果が大きくなるため、極性の増大に伴い、長波長化します。
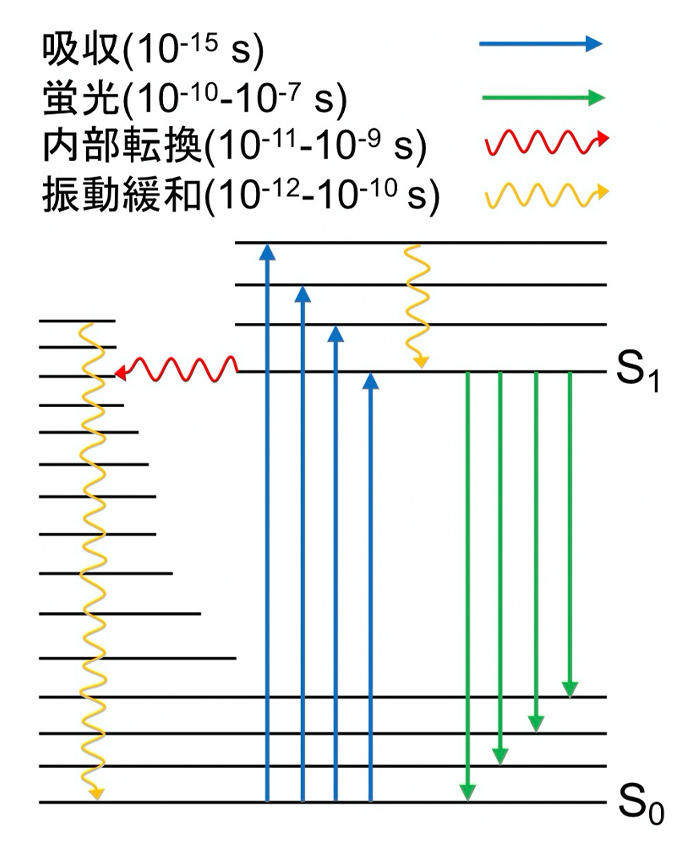
図2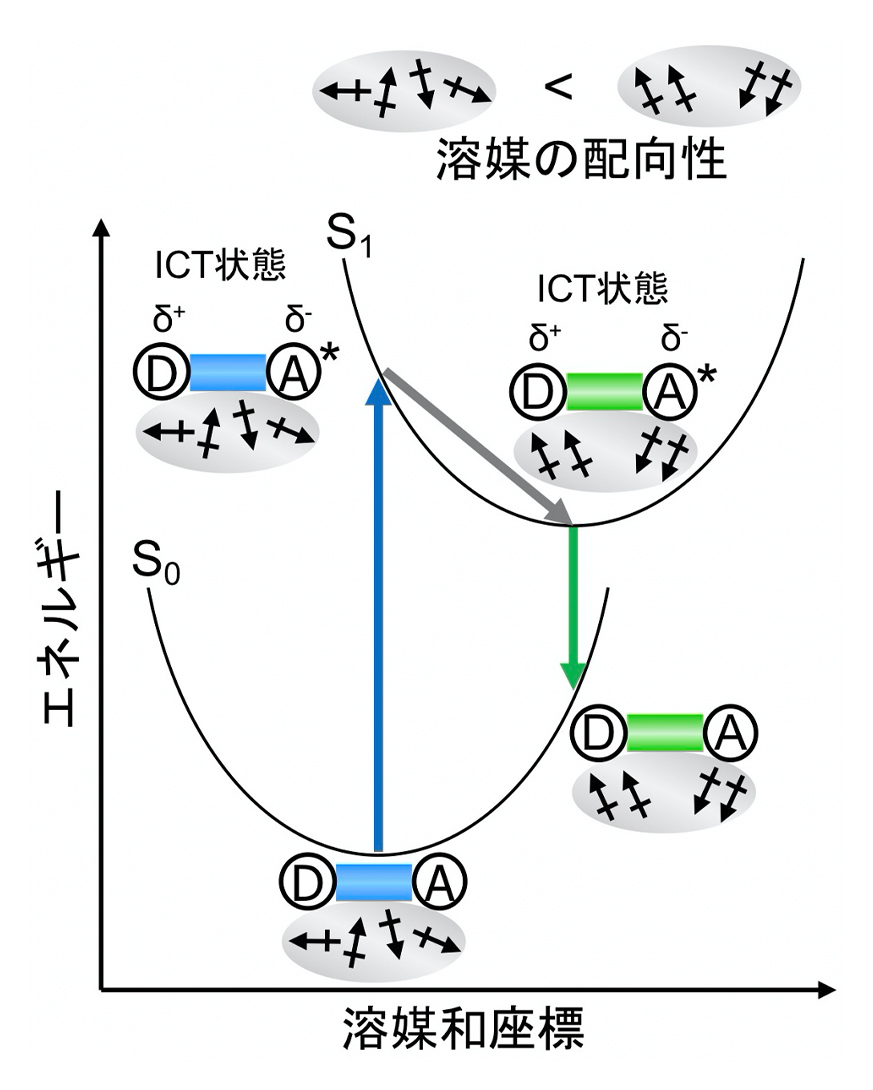
図3
蛍光分光を利用した臨界ミセル濃度の測定原理
ここまで説明してきたソルバトクロミック蛍光色素を利用した臨界ミセル濃度の測定原理について説明します。分子内に親水基と疎水基を併せ持つ界面活性剤は、水溶液に加えていくと、低濃度のうちは、疎水基を空気との界面に向けて存在しようとするため、その界面で濃度が高くなっています。徐々に濃度を高くしていくと飽和するが、疎水基同士を会合させることでミセルを形成します。この濃度を臨界ミセル濃度(critical micelle concentration; CMC)と言います。高分子においても、親水性と疎水性基を持つ両親媒性高分子は、CMC以上で高分子ミセルを形成します。ミセル内部は疎水基の集合体であり、本来、水に溶けない脂溶性の高い化合物でも、ミセルの内部に溶け込むことができます。洗剤は、この原理を利用して油汚れをきれいに洗い落とすことができます。ここで、油汚れの代わりに、ソルバトクロミック蛍光色素が水溶液中に存在していることを考えると、CMC以下では、周囲に水分子が存在しており、非常に極性が高い環境となっているが、CMC以上になると、ソルバトクロミック蛍光色素がミセルの内部に溶け込むことで、周囲に疎水基が存在し、極性が大きく低下します。この極性の変化を蛍光により検出することで、CMCを測定することができます。PyreneやNile Red(図4)がCMCの測定に汎用されているが、ここでは、上述したICT型のソルバトクロミック蛍光色素であるNile Redを用いた測定法について説明します
2)。Nile Redは、溶媒極性が高くなるにつれて、長波長側に極大蛍光波長をシフトさせます。さらに、水溶液中では強く消光し、CMC以上になると、ミセルの内部に溶け込むことで、蛍光強度が急激に増大します(図5)。この時、界面活性剤濃度に対する蛍光強度のグラフを作成し、変極点がCMCとなります(図6)。
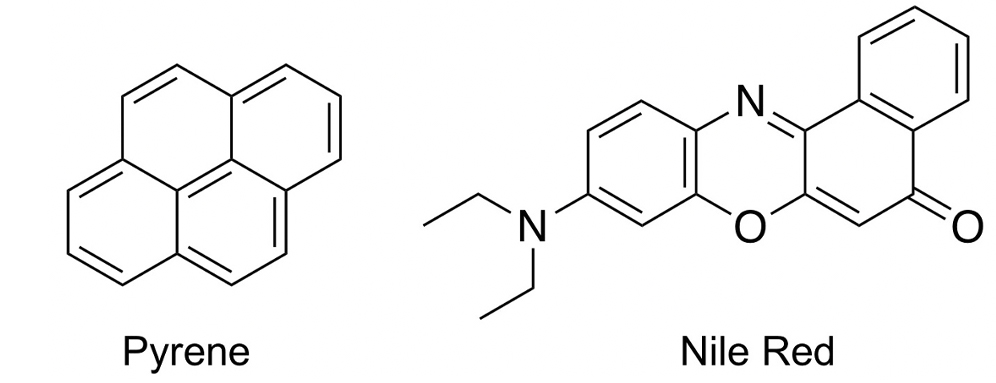 図4
図4
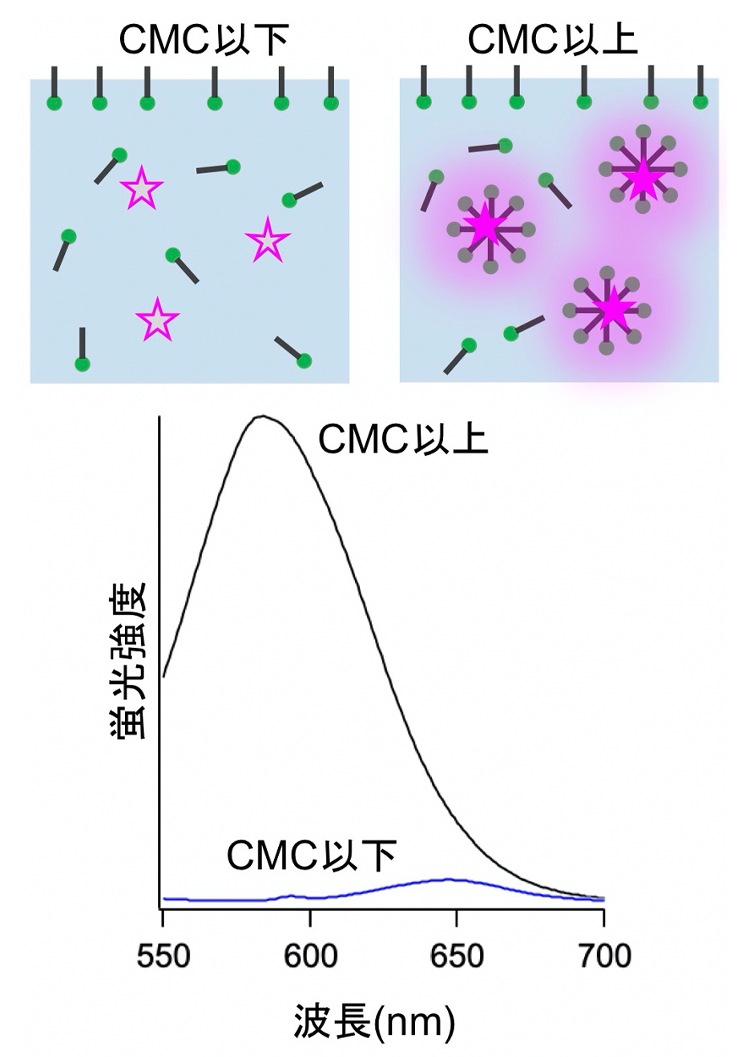
図5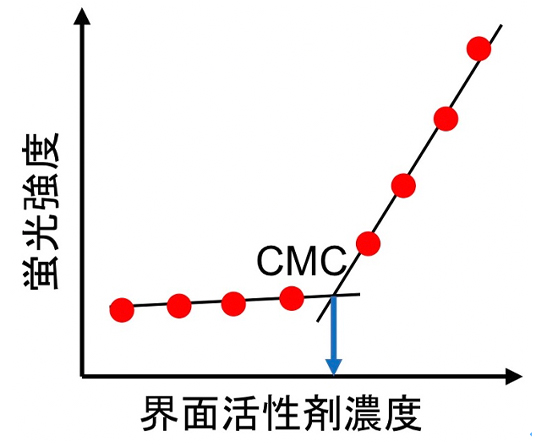
図6
温度応答性高分子応用した蛍光温度センサー
最後に、ソルバトクロミック蛍光色素を温度応答性高分子に結合させた細胞温度を測定できる蛍光プローブについて紹介します。温度は、生体分子の動態、反応性を変化させるため、細胞内環境の最も重要なパラメーターの1つです
3)。また、がん細胞などの病態細胞では、正常細胞よりも細胞内における反応活性が高く、熱生成(発熱)が大きい
4)、すなわち温度に違いが生じていることが知られています。そのため、細胞内温度をオルガネラレベルで測定できる技術は、生物学、医療分野において有用です。温度に応答して、蛍光特性を変化させる蛍光分子は存在するが、細胞温度(37 ˚C前後)を高感度に測定するには、感度が不十分です。そこで、温度に対して高感度に応答する温度認識部位、その認識による変化を高感度に蛍光シグナルに変化させる蛍光色素を結合させた蛍光プローブが考案されました
5)。温度認識部位には、Poly(
N-isopropylacrylamide) (PNIPAAm)に代表される温度応答性高分子が応用されています。PNIPAAmは、下限臨界溶解温度(Lower Critical Solution Temperature; LCST)である32 ˚Cを境に可逆的に鋭敏な相転移を起こします。LCST以下では、高分子鎖に対して、水分子の水素結合によって水和された状態です。LCST以上では、その水和結合が不安定化し、脱水和がおこり、高分子さは収縮し、さらに疎水性相互作用によって高分子が会合して相分離します。PNIPAAm以外にもLCST型の温度応答性高分子は存在し、また、親水性および疎水性モノマーとの共重合によりLCSTを調節することができます。蛍光色素が、この温度応答性高分子に結合されている場合、LCST以下では水和を受けているため、非常に極性が高い環境に存在していることになります。それに対して、LCST以上では、脱水和、高分子同士が会合した環境(ミセルの内部のような環境)となるため、極性が大きく低下した状態となります。上述したソルバトクロミック蛍光色素を用いれば、LCST前後での急激な相転移を蛍光シグナルに変換することができます(図7)。この蛍光プローブを細胞内に取り込ませて、蛍光顕微鏡で観察することで、細胞内の温度分布をイメージングすることが可能となります。
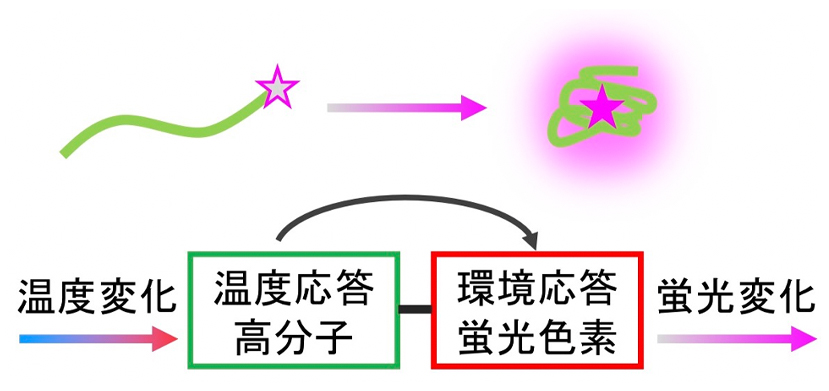 図7
図7
ここまで示してきたように、蛍光法は、高分子分析に応用でき、さらに、温度応答性高分子との組み合わせにより、細胞の蛍光イメージングに応用されています。
参考文献
1) B. Valeur, Molecular Fluorescence, Wiley-VCH, Weinheinm, 2002
2) A. M. Peterson, Z. Tan, E. M. Kimbrough, J. M. Heemstra, Anal. Methods, 2015, 7, 6877-6882
3) S. Duhr, D. Braun, Proc. Natl. Acad. Sci., 2006, 103, 19678-19682
4) M. Karneboen, D. Singer, M. Kallerhoff, R. H. Ringert, Thermochim. Acta, 1993, 229, 147-155
5) S. Uchiyama, C. Gota, T. Tsuji, N. Inada, Chem. Commun., 2017, 53, 10976-10992






