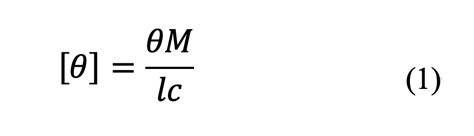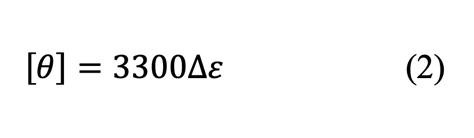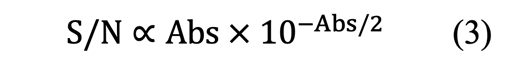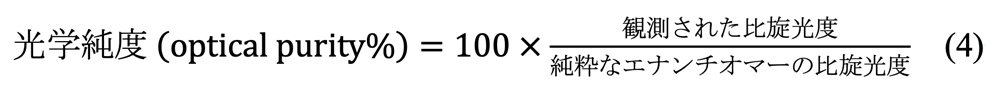執筆:前田勝浩・西村達也(金沢大学)
円二色性(Circular Dichroism: CD)は、試料(光学活性物質)の立体構造を解析する手法
円二色性(Circular Dichroism: CD)は、試料(光学活性物質)に右回りおよび左回りの円偏光を照射し、その吸収の差を測定して立体構造を解析する手法です。タンパク質やDNAなどの生体高分子は、高次構造に由来する特徴的なスペクトルを与えるため、スペクトルの形状から溶液中の構造を簡便に解析できます。さらに、2個の発色団をもつねじれた構造の未知サンプルは、励起子理論に基づいて絶対配置を決定することもできます。また、シグナル強度を利用して光学純度を測定することもできます。
測定できること
立体構造 / 立体配置 / 立体配座 / 高次構造 /
αヘリックス / βシート / ランダムコイル / ラセン構造 / ねじれ / 光学純度
原理
右手と左手のように、鏡映しの像と重ね合わすことのできない立体構造を持つ分子をキラル(cheir: ギリシャ語の手)であるといい、その性質のことをキラリティといいます。キラル化合物は、医薬・農薬に関する分野だけでなく、最先端の材料開発に関わる分野においても重要性を増しています。互いに鏡像関係にあるキラル化合物は、エナンチオマー(鏡像異性体)と呼ばれます。それらの融点、沸点、密度、極性などの物理化学的性質は全く同じであるため、エナンチオマーを区別することは一般に困難です。しかし、左・右円偏光に対するエナンチオマー間の吸収や屈折率が異なるため、一方のエナンチオマーが過剰に存在すると、円二色性(circular dichroism: CD)や旋光性といったキラル化合物に特有の性質を示します。したがって、これらを測定することにより、化合物のキラリティや光学純度の情報が得られるだけでなく、核酸やタンパク質などの生体高分子やキラルな合成高分子の溶液中の立体構造の同定や推定が可能になります。
光は、互いに直交する振動電場と振動磁場から形成される電磁波の一種です。自然光は、電場ベクトルの偏光面が放射状に分散して振動していますが、偏光子(ニコルプリズム)を通すと、一定の向きに沿った直線偏光(または平面偏光)を取り出すことができます(図1)。一方、1/4波長板を通して位相を90°ずらすと、光の電場ベクトルがらせん状に進行する円偏光(circular polarized light)になります(図2)。光の進行方向と向かい合う位置にいる観測者から見て、光の偏光面の回転方向が時計回りであれば右円偏光、反時計回りなら左円偏光といいます。直線偏光は、同じ振幅(強度)の右円偏光と左円偏光を重ね合わせた光に相当します。
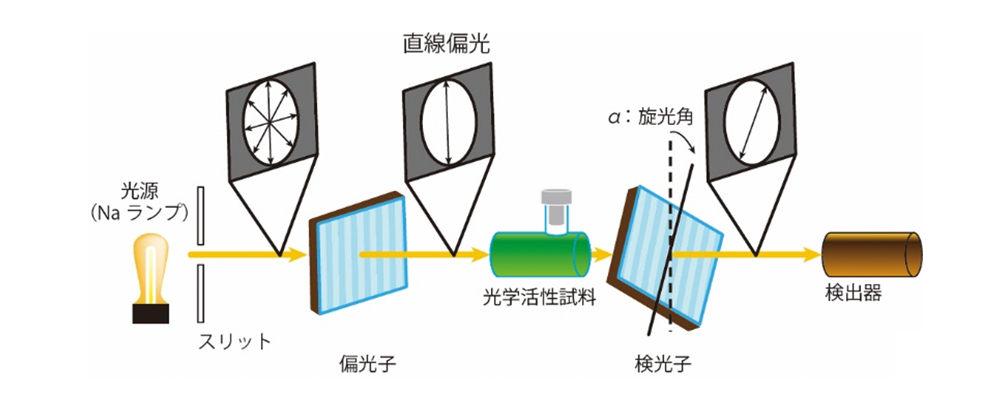 図1 直線偏光と旋光性
図1 直線偏光と旋光性 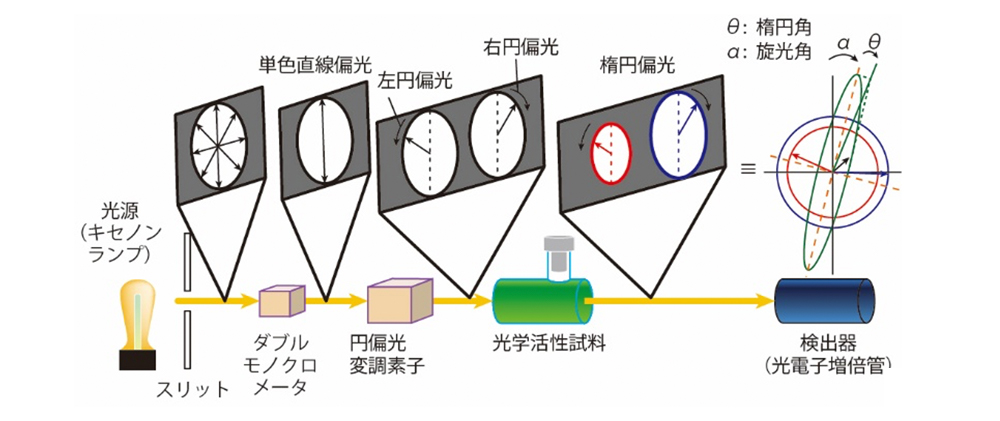 図2 CD分光計の概略図(円偏光と円二色性)
図2 CD分光計の概略図(円偏光と円二色性)
一対のエナンチオマーの溶液は、直線偏光の偏光面を時計回り(右旋性:dextrorotary,
d-)または反時計回り(levorotary,
l-)に一定の角度(
α)だけ回転させます(図1)。このように透過光の偏光面が入射光に対して回転する現象を旋光といい、このような旋光を示す性質を旋光性または光学活性といいます。旋光は、右円偏光と左円偏光に対するエナンチオマー間の屈折率が異なるために位相差が生じることによって起こる現象です。旋光性の波長依存性は、旋光分散(optical rotatory dispersion: ORD)といわれ、波長に対して規格化した旋光度をプロットしたものがORDスペクトルです。旋光の測定は、キラリティに関する最も古い分析方法ですが、簡便なため、現在でも血中糖濃度や果物の糖度測定など、糖の分析に活用されています。ORDの詳細については、専門書を参考にしてください
1)-3)。
一方、右円偏光と左円偏光に対する吸収率が異なると、透過光は振幅の異なる円偏光となり、その重ね合わせは楕円偏光として観察されます(図2)。この現象を円二色性(CD)といいます。楕円光の長軸と短軸の比に相当する正接(tan: タンジェント, tangent)を与える角度
θを楕円角(楕円率)といいます。近年は、測定結果の理論解析が可能であるため、光学活性分析に円二色性スペクトルを測定するようになりました。
CDの大きさは、式1で定義されるモル楕円率([
θ])あるいは、モル円二色性(∆ε)で表されます。
ここで、
θは実測の楕円角(degree)、
lはセル長(dm)、
cは溶液濃度(g/dL)、
Mは溶質の分子量を表しています。∆ε(dm
3mol
-1cm
-1)は、左偏光と右円偏光に対するモル吸光係数の差(ε
L-ε
R )であり、[
θ]と式2の関係にあります。
∆εまたは[
θ]の波長依存性を示したものが、CDスペクトルであり、紫外可視吸収スペクトルの吸収波長領域に対応した吸収型の曲線を示し、正の符号に曲線を示すものを「正のCotton効果」、負のものを「負のCotton効果」といいます。CDとORDは、互いにクラマース・クローニッヒの積分変換式によって変換できます
1)。
装置の動作原理
CD分光計の概略図を図2に示します。波長域が紫外線から赤外線までと幅広く、光量の大きなキセノンランプが一般的に使用されます。光源から出た光は、2つのモノクロメータによって調光され、単色直線偏光になります。これが円偏光変調素子により交互に左右の円偏光に変調され、光学活性試料を通過後、検出器によりそれぞれの光量が検出されます
4)-6)。左右の円偏光に対する吸収の差∆εが測定され、式2によって楕円率に換算されます。CD分光計が正しい波長と強度を示しているか、標準試料を用いて定期的に較正することが重要です。標準値として以下の溶液が用いられます(いずれも25ºCにおける値)。
- (+)-10-カンファースルホン酸アンモニウム水溶液 c: 0.06, ∆ε291= +2.40
- アンドロステロン 1,4-ジオキサン溶液 c: 0.05g/100 cm3, ∆ε304= +3.39
- (–)-パントラクトン水溶液 c: 0.015, ∆ε219= -5.00
測定の注意点
測定には、測定する波長領域に吸収がない溶媒を選択し、測定中に溶媒が揮発して試料濃度が変化しないように注意します。市販のスペクトル測定用溶媒を使用すればよいですが、溶媒に安定剤が含まれており、測定に影響をおよぼすおそれがある場合は、事前に除去します。測定試料を入れるセルとしては、円筒型や角型の石英製の固定セルが市販されています。スペーサーを用いる「貼り合わせセル」は、短い光路をつくりだせますが、粘性の低い溶液には不向きです。光路長の短いセルは、実際の光路長に大きな誤差がある可能性があるため、モル吸光係数が既知の物質を用いて、購入後に正確な検定を行う必要があります。
CDの値は測定温度により変化するため、恒温ステージなどを用いてセル内の温度を一定に保つべきです。また、CDの温度変化測定は、キラル分子のコンホメーション解析や反応速度解析などに有用な情報を与えます。ペルチェ式恒温装置(–10ºC〜110ºC)や液体窒素によるクライオスタット(〜–10ºC)などを利用すると、精度の高い温度制御が可能です。低温測定では、結露をさけるため乾燥窒素等で測定室をパージする必要があります。温度変化に伴う溶媒の密度変化にも注意し、同じ温度での紫外可視吸収スペクトルの測定による濃度補正が必要となります。
サンプル調製の際に重要な点は、測定波長領域の紫外可視吸収スペクトルの吸光度が2を越えないように、濃度とセル長を組み合わせることです。S/Nと吸光度の間には式3が成り立ちます。
すなわち、観察されるCD強度が小さい時に濃度を上げて吸光度2以上で測定しても、逆にノイズの強度が増大し、S/Nの改善にはなりません。むしろ吸光度1程度で測定する方が、少ない積算回数でS/Nの良いデータを得られます。また、吸光度が2を越えると偽シグナル(artifact)が観測されるため、注意が必要です。試料の測定後、同一セルを用いて溶媒のみの測定を行います(ブランク測定)。試料の測定値からブランク値を差し引いた値が、楕円角
θの実測値です。
CDスペクトルの解釈には、紫外可視吸収スペクトルが必要なので、対応する測定波長領域の紫外可視吸収スペクトルを必ず並行して測定し、吸光度が2を越えないことを確認します。吸光度とCD吸収がともに小さな領域は複数のセルを駆使して測定すると良いです。
測定法各論
光学純度の決定
純粋なエナンチオマーの比旋光度が分かっていれば、式4によって旋光計から光学純度の決定が可能となります。
光学純度の決定には古くから比旋光度が用いられてきましたが、値が小さく、試料が貴重な場合、CDのCotton効果の値(∆ε または[
θ])を用いて純度を求める場合があります。しかし最近は、市販の光学分割用HPLCカラム(またはGCカラム)を用いて、キラル化合物を光学分割し、その存在量(クロマトグラムの面積)の比から鏡像異性体過剰量(enantiomeric excess: ee%)として算出するのが一般的です。
絶対配置の決定
化合物の絶対配置を決定する場合、絶対配置が既知である物質と比旋光度を比較するのが一般的ですが、CDスペクトルの比較からも絶対配置を決定することができます。広い波長領域の比較ができるため、信頼性が増し、微量測定ができるメリットもあります。ただし、発色団が無い場合、注意が必要です。また、多くの有機化合物や錯塩化合物について、X線結晶構造解析や他の測定データから経験則(ケトンのオクタント則、共役ジエン・エノン類のラセン則など)
1)2),4)-7)が提唱されていますが、例外もあるので、適用には十分な注意が必要です。
X線結晶構造解析
8)と共に、非経験的な絶対配置の決定法として、励起子キラリティ法があります。これは2つ以上の発色団がねじれた位置で相互作用すると、符号が相反する分裂型のCotton効果を示し、そのパターンが発色団の立体構造に由来するという励起子理論に基づいています。時計回りのねじれ関係にある発色団は長波長側から正・負に分裂、反時計回りのねじれ関係なら負・正に分裂したCDスペクトルがそれぞれ得られます。発色団のない化合物では、化学反応により適当な発色団を導入して誘導体とすることで、励起子キラリティ法を適用できる場合があります。例えば、発色団として
p-ジメチルアミノベンゾアート基を2位と3位に導入したステロイド化合物は長波長側から正・負に分裂したCDスペクトルを与えます
9)。これより、2つの発色団が互いに時計回りにねじれた関係にあることがわかります(図3)。この方法は、糖、ステロイド、ジアミンや様々な天然物の絶対構造の決定に広く利用されています。
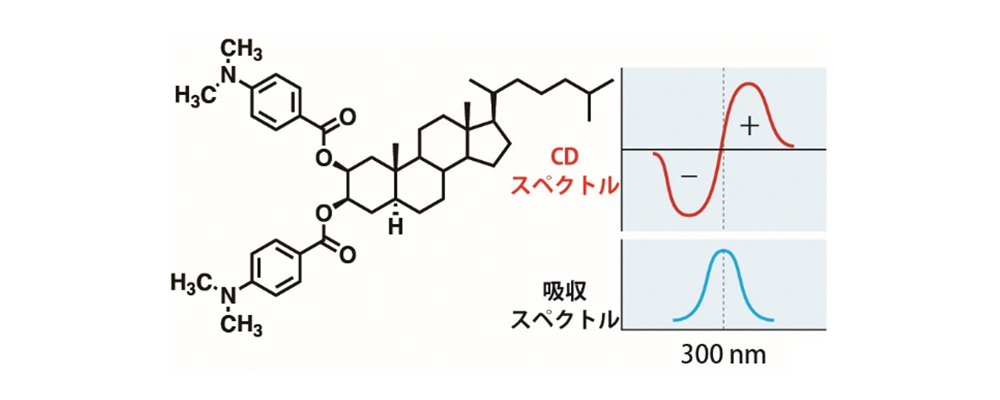 図3 p-ジメチルアミノベンゾエート基を2,3位に導入したステロイド化合物のCDと吸収スペクトル
図3 p-ジメチルアミノベンゾエート基を2,3位に導入したステロイド化合物のCDと吸収スペクトル生体高分子への応用
タンパク質や核酸は特徴的なCDスペクトルを示すため、溶液中における生体高分子の高次構造解析に古くから利用されてきました。タンパク質の
αヘリックス、βシート構造、ランダムコイルなどの二次構造を反映したCotton効果を遠紫外領域に示します
10)。解析ソフト(公開)を用いれば、CDスペクトルから二次構造に関する情報(割合など)が得られます。核酸も、ピッチの違いを反映した特徴的なCDスペクトルを示すため
7)、有用です。
キラルな合成高分子への応用
キラルな合成高分子、特に主鎖骨格に紫外可視吸収が有る場合、そのCotton効果から主鎖のコンホメーションに関する知見が得られます。このため、CDスペクトルは、一方向巻きに偏ったらせん構造を有する高分子の溶液中の立体構造を調べる際に威力を発揮します
7)。
固体CD
固体状態のキラル分子のCDスペクトルも原理的には測定できます。一般的に、粉末サンプルに対しては、KBr錠剤法やヌジョール法が用いられます。しかし、結晶、液晶、フィルム、膜、ゲルといった巨視的な異方性を持つサンプルは、直線二色性(liner dichroism: LD)や直線偏光複屈折(liner birefringence: LB)に起因するartifactを生じる可能性が高くなります。これらのartifactは真のCDシグナルより大きいため、巨視的な異方性を持つサンプルのキラリティ評価は、CDスペクトルのみではなくLBや LDスペクトルを併用し、慎重に行う必要があります
7)11)。
振動円二色性
赤外領域に観察される分子の振動遷移に基づく円二色性を、振動円二色性(vibrational circular dichroism: VCD)と呼びます。紫外可視領域に吸収を持たない分子でも赤外領域には吸収を有するため、測定可能であるという利点があります。また、密度汎関数計算(DFT計算)によりスペクトルの予測計算が可能であるため、計算と実測の比較からキラル分子の構造やコンホメーションが推測できます。一般的な赤外分光器はフーリエ変換型であり、全波長を同時測定できます。一方、円偏光変調素子は、ある波長λを中心に円偏光を変調しますが、λ以外の波長では楕円偏光となってしまうため、測定感度や信頼性が低下します。概ね0.66λ~1.33λの範囲で測定可能ですが、それ以外の範囲では、円偏光変調素子を再度調整するべきです。VCDはCDに比べて感度が低いため、その有用性に相反して、あまり使用されてきませんでしたが、最近では、VCD専用のパルス変調光を用いる高感度装置が市販され、キラル分子測定の有用な手法になってきました
6)7)。
参考文献
1) 高分子学会高分子実験学編集委員会編, 高分子実験学15巻−高分子における分光学, p.233, 共立出版(1984)
2) J. B. Lambertほか(務台, 小林訳)有機化合物の構造解析, 下, p.348, 東京化学同人(1979)
3) 浜口浩三, 武貞啓子, 生物化学実験法6-蛋白質の旋光性, 学会出版センター(1971)
4) 原田宣之, 機器分析のてびき(第2版)第2集, p.119, 化学同人(1996)
5) 日本化学会編, 第4版実験化学講座7, 分光II, 電子スペクトル, 丸善(1992)
6) N. Purdie, H. G. Brittain (ed.), Analytical Applications of Circular Dichroism, Elsevier Science (1994)
7) N. Berova, K. Nakanishi, R.W. Woody (ed.), Circular Dichroism - Principles and Applications (2nd ed.), Wiley-VCH (2000)
8) 原田宣之, 中西香爾, 円二色性スペクトル- 有機立体化学への応用, 東京化学同人(1982)
9) N. Harada, S.-M. L. Chen, K. Nakanishi, J. Am. Chem. Soc., 97, 5345(1975)
10) R. Townend, T. F. Kumosinski, S. N. Timasheff, G. D. Fasman, B. Davidson, Biochem. Biophys. Res. Commun., 23, 163(1966)
11) R. Kuroda, T. Harada, Y. Shindo, Rev. Sci. Instrum., 72, 3802 (2001)